Влияние кислотно - основных свойств растворителя
Диапазон кислотности и основности в системе ограничен амфотерными свойствами растворителя. Эти свойства обусловлены наличием промежутка между константами кислотности свободной молекулы растворителя $(S)$ и его протонированной молекулы $(SH^+).$
-
Вода уравнивает силу сильных кислот. Сила соляной кислоты $(pKa=-7)$ существенно отличается от силы серной кислоты $(pKa=-3)$, но в разбавленных водных растворах они будут одинаково сильными.
-
Близкие по значению силы хлоруксусная $(pKa=2,86)$ и дихлоруксусная $(pKa=1,26)$ кислоты будут существенно отличаться по степени диссоциации в воде.
-
Уксусная кислота $(pKa=- 6,2)$ является более слабым основанием, чем вода $(pKa=-1,74)$. Полностью в уксусной кислоте может диссоциировать только хлорная кислота. Азотная кислота способна диссоциировать в слабой степени, то есть ведет себя как слабая кислота.
Слабые кислоты в воде $(pKa(AH)
Значения $pK$ некоторых кислот в разных растворителях при $25^\circ C$
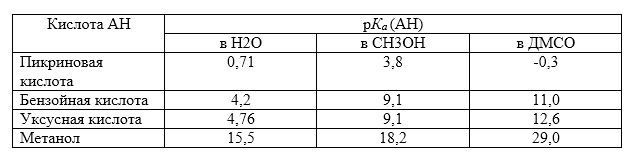
Рисунок 1.
ДМСО - диметилсульфоксид.
Влияние растворителя на реакции оснований:
-
Вода уравнивает силу оснований с $pKa (BH) > 16.$
Например: Ионы $NH_{2^-}K^+$, $C_2H_5O^-Li^+$, $CH_3SOCH_{2^-}Na^+$ ,при взаимодействии с водой образуют соответствующие сопряженные кислоты $NH_3$, $C_2H_5OH$, $CH_3SOCH_3$ и соответствующее количество гидроксид -- ионов $OH^-$. Но, в менее кислотном растворителе (например, $C_2H_5NH_2)$ основания сильнее $OH^-$ протонироваться не будут.
-
Основания, слабые в воде, будут эффективно протонироваться, если растворитель будет более кислотный, чем вода.
Например: В серной кислоте $H_2SO_4$ слабо основные в воде ароматические аммины $ArNH_3$ практически полностью протонированы. А азотная $HNO_3$ и карбоновые кислоты $RCOOH$ проявляют свойства оснований:
$H_2SO_4 + ArNH_3 ↔ H_2SO_4^- + ArNH_3^+;$
$H_2SO_4 + HNO_3 ↔ H_2SO_4^- + ON(OH)_2^+;$
$H_2SO_4 + RCOOH ↔ H_2SO_4^- + RC(OH)_2^+.$
Диапазон применения кислот и оснований в данном растворителе ограничивается степенью амфотерности растворителя. При низкой кислотности растворителя в нем проявляют свои основные свойства растворимые основания. При низкой основности растворитель не может уравнивать силу кислот, проявляющих в нем кислые свойства.
Если жидкость не проявляет ни кислотных, ни основных свойств, то она является плохим растворителем и для кислот и для оснований.
Сильные в воде кислоты и основания, такие как, $HNO_3$, $CH_3SOCH_3$, $NH=C(NH_2)_2$ плохо растворяются в углеводородах.
Существуют диполярные апротонные растворители (например, ДМСО -- диметилсульфоксид, ДМФА -- диметилформамид и др.). Они проявляют меньше кислотных или основных свойств (по сравнению с водой и другими гидроксильными растворителями), но хорошо растворяют полярные молекулы и соли.
Специфическая сольватация анионов
От того, как заряжена кислота, зависит влияние растворителя на кислотность. Кислоты с одинаковым зарядом, но помещенные в два разных растворителя, могут сильно отличаться по относительной кислотности.
Кислотная сила фенола при переходе от метанола к ДМСО убывает в $160$ раз, в то время как кислотность пикриновой кислоты возрастает в $13 \ 000$ раз. Данное различие связано со способностью растворителя образовывать водородные связи с анионами фенола и пикриновой кислоты.
Специфическая сольватация заключается в способности растворителя образовывать водородные связи с растворенным веществом. Это, так называемая «физическая сольватация», при которой не учитываются молекулярные свойства среды.
Водородная связь образуется между электроотрицательными элементами. Способность элементов участвовать в образовании водородной связи убывает в ряду:
$OH\dots O > OH\dots N$, $NH\dots O > NH\dots N > SH\dots X$, $XH\dots S > PH\dots X$, $XH\dots P > CH\dots X$, $XH\dots C$,
где $X$ - любой элемент.
Самые сильные водородные связи образуют между собой атомы азота и кислорода, наиболее слабые -- атомы углерода. К специфической сольватации с помощью водородных связей будут склонны более всего растворители, молекулы которых содержат группы - $OH$ или -$NH$ (карбоновые кислоты, спирты, первичные и вторичные амины). Наибольшее влияние эта сольватация оказывает на $OH^-$ и $NH^-$ кислоты.
Если сравнивать однозарядные кислоты по относительной кислотности от гидроксильных к диполярным апротонным растворителям, то наиболее сильное изменение кислотности проявляется, когда у одной из кислот в сопряженном состоянии заряд будет сильно делокализован.
Флуораден $(pKa~17)$ в метанольном растворе немного сильнее самого метанола $(pKa~18)$. В ДМСО для метанола $pKa=29$, а для флуорадена - $10,5$. Относительная сила кислот меняется во много раз. Метилат -- анион сильно сольватируется в метаноле в результате образования водородных связей. В анионе флуорадена заряд распределен по всем атомам углерода, поэтому ион не образует водородные связи с гидроксильной группой. Такой анион будет одинаково сольватироваться как в ДМСО, так и в метаноле. Метилатный ион способен образовывать сильные водородные связи, и более сольватируется метанолом. При переходе от растворов в метаноле к растворам в ДМСО метилатный ион дестабилизируется.
Анионы способны образовывать комплексы с присутствующими в растворе катионами. Такие комплексы называют ионными парами. В таких парах разноименные ионы связаны друг с другом, главным образом, силами электростатического притяжения.
Случаи возникновения ионных пар:
-
если катионом выступает ион аммония $NH_4^+$, то помимо ионных пар образуются и водородные связи;
-
ионные пары образуются в системах с низкой диэлектрической проницаемостью, которые плохо сольватируют ионы (моноамины, углеводороды, простые эфиры и др.);
-
в диполярных апротонных растворителях (ДМСО, ацетон, ацетонитрил и др).
Сольватация, связанная с поляризуемостью
Между двумя индуцированными диполями, между диполем и индуцированным диполем существует взаимодействие. Оно будет увеличиваться с ростом поляризуемости взаимодействующих молекул и уменьшаться с увеличением расстояния между ними.
Большой поляризуемостью обладают ионы или молекулы, в которых электроны сильно делокализованы. Поэтому, при исчезновении или образовании в ходе реакции частиц с сильно делокализованными электронами, на реакцию начинает оказывать воздействие изменение поляризуемости растворителя.
Сольватация, обусловленная поляризуемостью, будет мала, если растворитель состоит из небольших молекул.
У воды эффективная поляризуемость намного меньше, чем у большинства растворителей. Это обусловлено строением молекулы воды. Атом кислорода связан простыми связями с атомами водорода, при этом все атомы небольших размеров. Когда молекулы воды окружают молекулу растворенного вещества, каждый атом из молекулы воды располагается очень близко к некоторой области большой молекулы растворенного вещества (первый слой молекул воды). Молекулы воды второго слоя расположены дальше от молекулы растворенного вещества на величину ван-дер-ваальсова расстояния между двумя молекулами воды.
В случае, когда молекула растворенного вещества окружена крупными молекулами растворителя, второй слой растворителя состоит в основном из тех молекул, к которым принадлежат и атомы первого слоя. Атомы второго слоя расположены от молекулы растворенного вещества на длину ковалентной связи, которая меньше ван-дер-вааальсовых радиусов. Следовательно, второй слой атомов будет более активен в дисперсионных взаимодействиях с растворенным веществом.











