Прогноз продуктов реакции
Теория жестких и мягких кислот и оснований помогает:
-
Предсказать наиболее стабильные продукты реакции между нуклеофильными и электрофильными веществами;
-
Оценить состояние равновесия реакций, для которых отсутствуют точные термодинамические характеристики.
«Симбиоз» - процесс укрепления связи между соединениями одинаковой степени тяжести, вступающими в реакции. Жесткие заместители делают кислоты и основания более жесткими, а мягкие заместители -- более мягкими.
При взаимодействии мягкой кислоты $BH_3$ с мягким основанием $CO$ образуется устойчивое соединение $BH_3 \cdot CO$. Если $BH_3$ вступает во взаимодействие с жесткими основаниями (аминами, эфирами), то стабильный аддукт не образуется. Жесткая кислота $BF_3$ легко взаимодействует с жестким основанием с образованием с образованием $BF_3 \cdot OR_2$ или $BF_3 \cdot NR_3$. Соединение $BF_3 \cdot CO$ будет неустойчиво, так как наблюдается неустойчивая комбинация жесткое -- мягкое, что противоречит принципу ЖМКО.
- Предсказать продукты обменных реакций между солями.
В результате реакции йодида лития $LiI$ со фторидом серебра $AgF$, проходящей в твердой фазе или в растворе, образуются более стабильные соли (жесткая кислота -- жесткое основание $LiF$ и мягкое основание -- мягкая кислота $AgI$).
Образование координационных соединений, ${\mathbf \pi }$ - комплексов
- Теория ЖМКО помогает описать отличия в способности галогенид -- ионов участвовать в образовании координационных соединений с катионами разной степени жесткости.
С катионом $Al^{3+}$ (жесткая кислота) последовательность имеет следующий вид: $F^-$, $Cl^- > Br^- >I$, при этом стабильность убывает; с катионом ртути $Hg^{2+}$ (мягкой кислотой) соединения более стабильные будут иметь обратное направление.
-
Выяснено, почему осуществляется стабилизация жесткими основаниями типа $F^-$, $OH^-$, $O^{2-}$ металлов, обладающих высокой степенью окисления.
Центральные ионы металла с большим зарядом являются жесткими кислотами. Наоборот, мягкие кислоты -- ионы с малым зарядом -- стабилизируются мягкими основаниями (например, $CN^-$, $I^-$, $CO$).
-
Теория кислот и оснований Пирсона объясняет реакции между акцепторами $\pi $ --электронов ($CO$, $R=N=C$, $NO$, замещенные фосфины) и переходными металлами.
Образование карбонильного соединения никеля:
$Ni + 4CO ↔ Ni(CO)_4$
Атомы никеля в кристаллической решетке не заряжены, являются мягкими кислотными центрами. К ним присоединяются мягкие основные молекулы $CO$, имеющие свободную пару электронов. $\sigma $ -- связи между центральными атомами никеля и атомами молекул $CO$ усиливаются $\pi $ -- дативными связями. Высокая электронная плотность нейтрального атома металла перераспределяется на лиганды. В результат этого электронная плотность распространяется по всей молекуле более равномерно.
Всевозможные $\pi $ -- комплексы являются стабильными соединениями в комбинации мягкая кислота -- мягкое основание. Донором электронов в этих соединениях выступают $\pi $ -- электронные системы непредельных или ароматических веществ, а в результате реакции с кислотой также образуется $\pi $ -- связь. Мягкими основными компонентами являются ароматические или непредельные лиганды, мягкая кислота -- атом d- металла (в низкой степени окисления).
Донорная связь $\sigma $ -- типа образуется за счет занятой $\pi $ -- орбитали лиганда и свободной гибридной орбитали $d$- металла. Упрочнение связи, выравнивание электронной плотности происходит за счет образования дативной связи.
Типичные представители -- бис(бензол)хром $(C_6H_6)_2Cr$, бис($\pi $ -- циклопентадиенил)железо $((\pi -C_5P_5)_2Fe$ -- ферроцен), которые имеют структуру двойной кегли или сендвича.
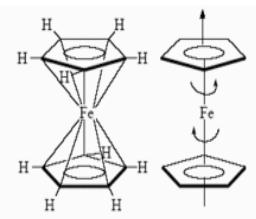
Рисунок 1. Структура $\pi $ -- комплекса ферроцена.
- Некоторые молекулы могут одновременно иметь и жесткие и мягкие центры. Жесткие кислоты (протон и др.) прочно связываются с атомом кислорода. Мягкие кислоты (соли платины и палладия) могут образовывать прочные координационные соединения.
В молекуле диметилсульфоксиде атом кислорода проявляет жесткие свойства, вследствие высокой электронной плотности. Атом серы является мягким основным центром в результате особенностей электронной структуры.
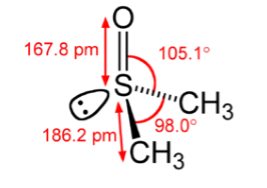
Рисунок 2. Строение молекулы диметилсульфоксида
Оценка положения равновесия реакции
Для предсказания положения равновесия необходимо знать качественное деление на жесткие и мягкие кислоты и основания:
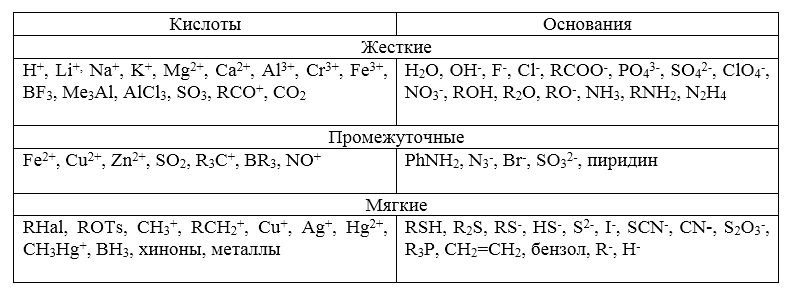
Рисунок 3.
Метанол и метилиодид являются продуктами взаимодействия мягкой кислоты $CH^{3+}$ , жесткого основания $OH^-$ и мягкого основания $I^-$. На основании теории ЖМКО можно предположить, в реакции метанола с иодоводородом равновесие должно сместиться вправо, так как в результате образуются связи, соответствующие принципу «мягкий -- мягкий», «жесткий -- жесткий».
$CH_3OH + HI - CH_3I + HOH$
константа равновесия очень велика: $K ≈ 109$ при $25^\circ \ C$, что подтверждает смещение равновесия вправо.
Теория ЖМКО помогает прогнозировать и объяснять реакции между нуклеофильными и электрофильными соединениями, давать оценку стабильности образовавшихся веществ.











