Влияние заместителей на кислотность
Электроноакцепторные заместители способны увеличивать кислотность атомов водорода, которые связаны с атомом углерода.
При введении одного атома хлора в молекулу метана наблюдается повышение кислотности соединения. При последующем введении второго и третьего атомов хлора кислотность будет усиливаться и хлороформ начинает отщеплять протон при действии концентрированного раствора гидроксида натрия $NaOH$.
В результате образуется неустойчивый трихлорметильный анион, способный быстро отщеплять ионы хлора с образованием дихлоркарбена.
Дихлоркарбен представляет собой очень реакционноспособную частицу, практически мгновенно реагирующую с компонентами среды при нормальных условиях:
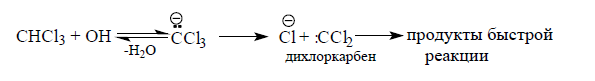
Рисунок 1.
При распаде трихлорметильного аниона кислотно -- основное равновесие смещается, поэтому значение $pka$ можно указать только приблизительно.
Стабилизацию карбанионного центра атомами хлора можно объяснить отрицательным индуктивным эффектом.
В ряду галогенов индуктивный эффект увеличивается от йода к фтору, а кислотность галоформов возрастает от фтора к йоду.

Рисунок 2.
Стабилизирующий и дестабилизирующий эффекты
Галогены могут проявлять дополнительный стабилизирующий (возрастает от фтора к йоду) или дестабилизирующий (возрастает от йода к фтору) эффекты.
-
Стабилизирующий эффект заключается в участии отрицательного заряда $d$-орбиталей галогена в делокализации. У фтороформа $d$-орбитали фтора находятся высоко и сопряжение типа $p-d$ невозможно:
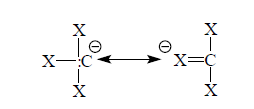
Рисунок 3.В качестве $X$ могут выступать $I, \ Br, \ Cl$. Фтор выполнять роль заместителя в данном случае не может.
-
Влияние дестабилизирующего эффекта на кислотность галоформов. Дестабилизирующей эффект (+М)-типа проявляется в отталкивании между неподеленными электронными парами галогена и углерода ($X=F \gg Cl, Br$):
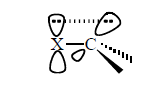
Рисунок 4.Этот эффект также называют антисопряжением. Наиболее сильно он проявляется у фтора. И углерод и фтор находятся во втором периоде, имеют близкие размеры орбиталей и поэтому перекрываются наиболее эффективно.
Влияние хлора и фтора на кислотность можно сравнить по величинам констант ионизации замещенных нитрометанов:
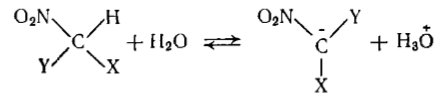
Рисунок 5.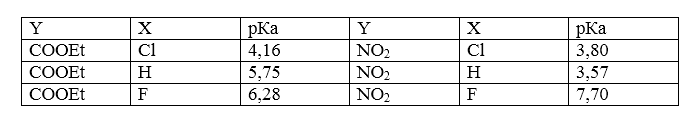
Рисунок 6.В случае галогена, который связан с карбанионным центром (а) кислотность растет в ряду$Cl >F$. Фтор оказывает самое слабое влияние на кислотность и отталкивание пар электронов будет компенсироваться индуктивным эффектом (б). В случае (в) чрезвычайно легко протекает $\beta $-элиминирование и фтор также активен, как хлор.
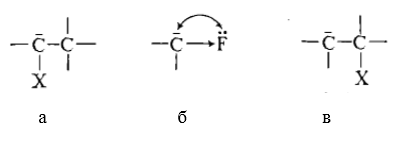
Рисунок 7.
Галогенирование кетонов
Одним из ранних предположений о роли карбанионов как интермедиатов реакции появилось на основании реакции бромирования ацетона в присутствии водного раствора щелочи. Эта реакция не зависит от концентрации брома подчиняется кинетическому уравнению
Позже было показано, что реакции йодирования проходят с такой же скоростью, что и реакции бромирования.
На образование карбанионного интермедиата указывают:
- индуцируемый основанием дейтеро -- водородный обмен;
- рецемизация оптически активного кетона;
- практически одинаковые скорости обмена и рацемизации;
- кинетический изотопный эффект ($k_H >k_D$);
- $\alpha $-Н-атом замещается дейтерием, то есть расщепление $CH$-связи является медленной, лимитирующей скорость стадией.
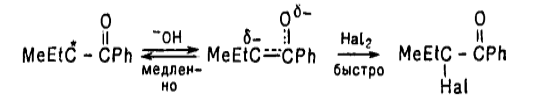
Рисунок 8.
На этот интермедиат происходит быстрая атака каким нибудь электрофилом: $Cl_2$, $Br_2$, $I_2$. В результате чего образуется конечный продукт реакции.
При бромировании $MeCH_2COCH_3$ $1-$ и $3$-бромбутаноны образуются практически в равных количествах, а затем быстро подвергаются дальнейшей реакции. Алкильная группа ($R$) проявляет индуктивный эффект, который оказывает на кислотность атома водорода (устойчивость образующегося аниона) относительно небольшое влияние.
Введение в молекулу кетона атома галогена оказывает заметное влияние на дальнейшее галогенирование.
Проявляемые бромом сильный электроноакцепторный индуктивный эффект и эффект поля, повышают кислотность $\alpha-H$-атомов группы $CH_2Br$ по сравнению с $\alpha-H$-атомами группы $RCH_2$. В результате электроноакцепторного действия атома брома, каждая последующая стадия бромирования будет идти быстрее предыдущей.
Конечными продуктами реакции являются карбоксилат -- ион и галоформ. Суммарный процесс галоформной реакции:
$RCH_2COCH_3 → RCH_2CO_{2}^- + HCX_3$
Данную реакцию применяют для обнаружения метилкетонов с применением йода и водного раствора щелочи. В результате образуется нерастворимый в реакционной среде иодоформ $CH_3I$ -- продукт желтого цвета с характерным запахом.
Расщепление связи $C-CBr_3$ возможно и в сильнощелочной среде:
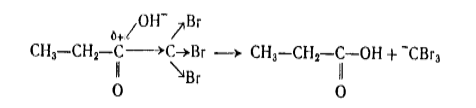
Рисунок 9.












