Определение карбанионов
Карбанионы -- это органические частицы, отрицательно заряженные, содержащие четное число электронов, два из которых не связаны с атомом или группой атомов и представлены в виде неподеленной электронной пары.

Рисунок 1.
Большим сродством к электрону, чем углерод, обладают элементы, которые в Периодической системе находятся правее углерода. Например: фтор $F$, кислород $O$, азот $N$. Обратное направление поляризации связи наблюдается при $C-H$-связи или связи углерода с металлами.
Карбанионы являются важными интермедиатами в органических реакциях.
Химию карбанионов можно рассматривать как химию $C-H$ кислот и их металлических солей.
Способы получения карбанионов
Диссоциация $C-H$-связи:

Рисунок 2.Например: кислотность $C-H$ кислот можно определить, используя спектрофотометрический метод.
Шкала кислотности МСЭД отражает термодинамическую кислотность:
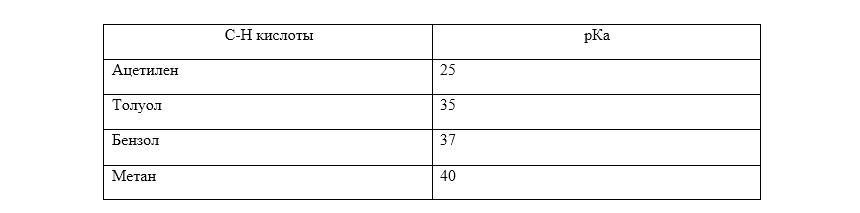
Рисунок 3.Кислотность $C-H$-кислот в газовой фазе отлична от кислотности в растворах.
Пример 1Кислотности спиртов в газовой фазе убывает в ряду:
- третбутиловый $ >$ изопропиловый $ >$ этиловый $ >$ метиловый $ >$ вода;
в гидроксилсодержащих растворителях кислотность возрастает в ряду:
- вода $
При получении карбанионов из органических соединений в системе должны присутствовать сильное основание и протоноакцепторный растворитель.
Среди растворителей выделяют:
доноры протонов: полярные растворители (низшие спирты, вода); неполярные растворители (высшие спирты, анилин и др.);
акцепторы протонов: полярные растворители (диметилформамид, диметилсульфоксид и др.); неполярные растворители (диэтиловый эфир, диоксан, тетрагидрофуран и др.)
По увеличению активности в органических средах основания -- анионы располагаются в ряду: гидроксиды, алкоголяты, феноляты и ацетаты, гидриды, амиды, металлорганические соединения (алкил, арил-металлы), четвертичные аммониевые основания. Чаще всего для получения карбанионов используют металлорганические соединения и четвертичные аммониевые основания.
Нуклеофильное присоединение анионов к кратной связи:

Рисунок 4.Если в олефины ввести электронооттягивающие заместители ($C\equiv N$, $COOR$, $COR$, $NO_2$,), то это приведет к уменьшению электронной плотности кратной связи, что, в свою очередь, облегчит атаку ее нуклеофилами.
Пример 2\[NO_2-CH=CH_2 + A^- ↔ NO_2-CH^--CH_2-A\]Полученные в результате реакции нуклеофильного присоединения карбанионы могут принимать участие в
реакции Михаэля;
анионной полимеризации винильных мономеров;
нуклеофильном замещении у олефинов и ароматических углеводородов и т.д.
как промежуточное вещество в реакциях:
обмена галогена на металл
\[C_6H5I + R-Me ↔ C_6H_{5-}Me^+ + RI\],взаимодействия металлов с галогенпроизводными
\[CH_3Cl + Me ↔ CH_{3-}Me+Cl\]обмена между металлами в металлалкилах
\[2Me + R_2Hg ↔ 2R-Me^+ + Hg\]расщепления простых эфиров воздействием металла
\[C_6H+5OCH_3 + 2Me ↔ C_6H_{5-}Me^+ + MeOCH_3\]
Особенности химических взаимодействий карбанионов
Активность карбанионов зависит от устойчивости и своего присутствия в составе ионной пары.
Процессу диссоциации предшествует процесс ионизации, при котором образуются два типа ионной пары: тесной или контактной (1) и разделенной или рыхлой (2):
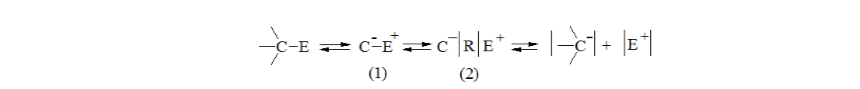
Рисунок 5.
Следует учитывать особенности растворителей:
Свободных ионов и ионных пар не существует в растворителях углеводородной природы, в них присутствуют только малополярные ассоциаты.
В растворителях -- амидах ионы образуют прочные пары.
В растворителях -- гидридах ионы образуют ионные пары или выступают в виде свободных ионов.
Доля разделенных ионных пар по отношению к доле контактных пар увеличивается в одном и том же растворителе при уменьшении размеров и повышении степени поляризации катионов.
Ассоциация ионов с увеличением температуры растет в большинстве растворителей. Некоторые реакции с участием карбанионов протекают энергичнее при низких температурах.
Реакции с участием карбанионов
Протонирование карбанионов. Это процесс обратный получению карбанионов из $C-H$ --кислот. Используется для получения других карбанионов с помощью одного стабильного.
Пример 3Получение трифенилметильного карбаниона:

Рисунок 6.Реакция обмена металлорганических соединений с соединениями, имеющими подвижный водород.
Пример 4Рреакции применения реактивов Гриньяра:

Рисунок 7.Реакции замещения.
Пример 5Алкилирование карбанионов алкилгалогенидами. При этом
активность алкилгалогенидов обычно меняется в последовательности:
иодиды$ >$бромиды$ >$хлориды. Похожая реакция протекает с ацетиленидным ионом:

Рисунок 8.Реакции нуклеофильного присоединения карбанионов по кратным связям $C=C$ и $C=O$.
Пример 6Первая реакция лежит в основе анионной полимеризации, которая может протекать при очень низких температурах с высокой скоростью.
Примерами реакций по связи $C=O$ являются: бензоиновая и сложноэфирная конденсация альдегидов, альдольная, ряд именных реакций (Перкина, Михаэля и т.д.).












