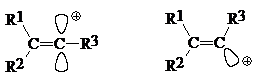Эти катионы малостабильны, поскольку орбиталь, несущая положительный заряд, ортогональна $\pi$-системам и не может с ними взаимодействовать. Поэтому неудивительно, что ни винильный, ни фенильный катионы до настоящего времени в растворах суперкислот в виде устойчивых частиц не идентифицированы.
Считается, что винильные катионы имеют линейную структуру, а не тригональную:
Рисунок 1.
Этим, в частности, объясняется более высокая стабильность арил-винильных катионов, выражающаяся в том, что соединения типа $R_2C=C(Z)Ar$ могут реагировать по механизму $SN1.$
Арильные катионы
В последнее время арильные катионы ($AK$) стали объектами как экспериментальных, так и теоретических исследований ряда ученых. Такой интерес вызван особой природой $AK$, имеющих близкие по энергиям синглетный и триплетные состояния. В частности, М. Сперанза и др. получили смесь орто-, мета- и пара-нитрофенильних катионов за счет ядерного распада тритийзамещеного нитробензола в газовой фазе при наличии паров метанола. Однако продукт присоединения метанола и 2-нитрофенильного катиона не был идентифицирован в реакционной смеси.
Арильные катионы играют важную роль в химии как високореакцийноздатни интермедиатов, открывающие путь к образованию новых связей $C-C$ для широкого ряда $\pi$-нуклеофилами и $C-X$ (где $X = O, N, S$ и т.д.) в случае n-нуклеофилов. Это дает возможность избежать применения дорогостоящих катализаторов (как в реакциях Гека, Сузуки, Негиши или Соногаширы), а также образования значительного количества смолоподобные продуктов (как в реакции Меервейна). С другой стороны, при генерировании іn vivo, ионы $Ar^+$ способны разрушать молекулу ДНК и, таким образом, использоваться как цитотоксические препараты.

Рисунок 2.
Катионы $Ar^+$ полициклических ароматических углеводородов найдены также в межзвездной среде как одни из наиболее распространенных органических компонентов космической пыли и внеземной углеводородного плазмы. Высокая реакционная способность катионов $Ar^+$ дает возможность связать молекулярный азот в азотсодержащих органических молекул. Такие реакции протекают на Титане (спутнике Сатурна), а также могли иметь место при формировании ранних форм жизни на Земле. Дикатионы бензидина, что по структуре соответствуют продуктам рекомбинации триплетных ионов $Ar^+$ используются при визуальном колориметрическом экспресс-определении гипохлорита, который применяется как многотоннажный рагент для борьбы с микробиологическим загрязнением сточных, а также промышленных циркуляционных вод.
2-нитрофенильный катион
В качестве примера типичного арильного катиона можно рассмотреть 2-нитрофенильный катион. Природа взаимодействия в нем между группой -$NO_2$ и ароматическим ядром определяется близостью расположения вакантной $\sigma$-орбитали кольца и атома кислорода. Как известно, синглетный фенильный катион имеет структуру $\pi 6 \sigma 0$, в то время как триплетный - $\pi 5 \sigma 1$. Значительная електрофильнисть атома углерода С (4) вызывает образование связи по донорно-акцепторному принципу, что в свою очередь приводит к разрыву связи $O$ (13) -$N$ (11) и образования связи $B$ (13) -$C$ (4) = 1.314 $A$. образующийся цикл чрезвычайно неустойчив, поэтому ковалентная связь $O-O$ не образуется.
Исходя из классических представлений о валентности для такого катиона, можно предложить ряд резонансных структур:
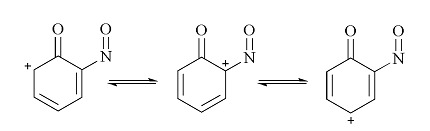
Рисунок 3.
Однако расчеты показывают делокализацию заряда с наибольшим вкладом в атоме углерода $C$ (4) (0.453 е). Очевидно, что стабилизацию данного катиона за счет присоединения нуклеофила следует ожидать именно в это положение. Стабилизация данного катиона также может произойти при депротонировании. Такие реакции встречаются при фотохимическом получении $AK$.
Расчеты показывают, что депротонирование атома углерода $C$ (2) на 18.7 ккал / моль более энергетически выгодным чем атома углерода $C$ (1). Образованое соединение будет представлять собой триплетный карбен, что на 8,8 ккал / моль более устойчив чем синглет.
Строение 2-нитрофенильного катиона
Для большинства циклических карбенов синглетное и триплетное состояния является одноцентровыми. В случае синглета пара электронов занимает $\sigma$-орбиталь, в то время как триплетный карбен характеризуется $\sigma \pi$-состоянием.

Рисунок 4. Триплетный и синглетный карбены с локализацией пары электронов на одном центре. Автор24 — интернет-биржа студенческих работ
Расчеты полученного карбена показывают, что неспаренные электроны являются преимущественно делокализованными на атоме $C$ (2) (1.021) и группе -$N$ = $O$ (суммарная спиновая плотность 1.014), причем одна орбиталь относится к $\sigma$-типу (рис. 2 а), а другая - $\pi$- типа (рис. 2, б), характеризующий триплетный состояние.
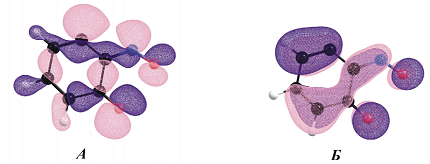
Рисунок 5. Молекулярные орбитали неспаренных электронов полученного карбена. Автор24 — интернет-биржа студенческих работ
Такая сильная делокализация электронов исключает спин-орбитальное взаимодействие между триплетом и синглетом, которое характерно для большинства известных карбенов. Поэтому можно сделать вывод о том, что несмотря на незначительную разницу в энергии между этими состояниями триплетное основное состояние должен быть достаточно устойчивым.