Одними из первых подробно изученных реакций электрофильного замещения были реакции нитрования. Они были широко изучены для многих ароматических соединений и для них были определены относительные реакционные способности для различных положений в молекулах. Кроме того, изучая реакции смеси бензола с некоторыми другими соединениями часто можно определить количественную реакционную способность различных положений в соединениях относительно бензола. Эти статистически уточнененные относительные реакционные способности и называют факторами парциальной скорости.
Парциальные скорости на примере замещения в толуоле и бензоле
Например, взаимодействие эквимолярных количеств толуола и бензола с малым количеством азотной кислоты в уксусном ангидрид при $30^\circ \ C$ дает одну часть нитробензола на $27$ частей нитротолуолов. В образовавшихся нитротолуолах содержится $58.1\%$ орто-, $3.7\%$ мета- и $38.2\%$ пара- изомеров. Факторы парциальной скорости $f$ для орто- изомера может быть рассчитан следующим образом:
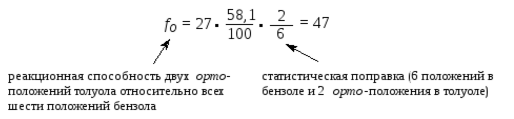
Для пара- и мета- изомеров следовательно факторы парциальной скорости будут рассчитаны как:
-
для $38.2\%$ пара- изомера
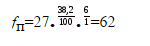
-
для $3.7\%$ мета- изомера
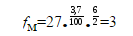
Факторы парциальной скорости для некоторых замещенных бензола
Факторы парциальной скорости для реакций нитрования некоторых замещенных бензола приведены на рисунке 4.
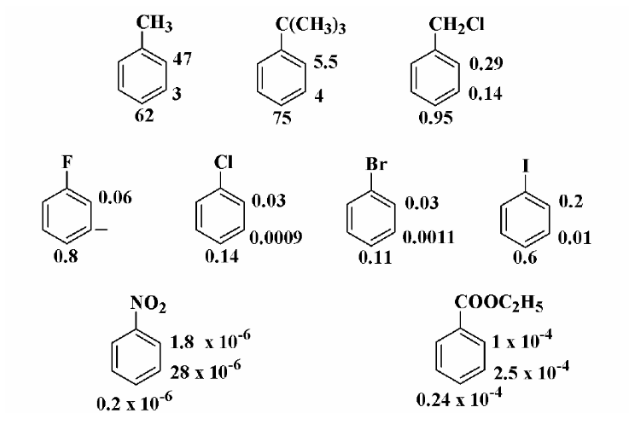
В этих результатах ярко проявляются некоторые эффекты. Например, трет-бутильная группа влияет почти так же на мета- и пара-положения, как и метильная группа, но орто-положение трет-бутилбензоле гораздо менее реакционноспособные, чем в толуоле. Ясно, что такую разницу надо приписать стерическим препятствиям, вызванных объемной трет-бутильной группой. В более отдаленных мета- и пара-положениях размер алкильной группы имеет меньше пространственное значение.
Замещение в галогенбензолах
Галогенбензолы подчиняются общей теории замещения, изложенной в предыдущих разделах. Все положения в них менее реакционноспособные, чем в бензоле, но мета- положение дезактивовировано сильнее, чем орто- или пара- положения. Хлорметильная группа особенно интересна тем, что стабилизирующий эффект алкильной группы накладывается на дезактивирующие влияние диполя углерод - хлор. Суммирующим результатом этого является орто-, пара- ориентация при небольшой дезактивации этих положений.
Реакционная способность при дейтерировании
Количественные данные для оценки реакционной способности недостаточны. Количества, в которых образуются некоторые изомеры, слишком незначительны, чтобы их определить даже современными методами газовой хроматографии. Одним из методов получения количественных данных о реакционной способности для всех положений в данной молекуле, даже когда они значительно отличаются по активности, было изучение реакции самого простой из возможных реакций электрофильного ароматического замещения - замены одного изотопа водорода на другой. Пример такой реакции был дан ранее.
В принципе, можно приготовить ряд меченых определенным образом ароматических соединений и количественно исследовать скорость потери изотопа водорода при последовательной их смене в условиях реакции. Сравнение скорости замещения дейтерия водородом (протодедейтерирования) определенным образом дейтерированных анизолов с соответствующими скоростями дейтеробензола в водной перхлоратной кислоте дает результаты, показанные на рисунке 5.
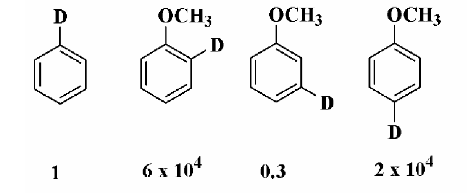
Эти результаты демонстрируют повышенную реакционную способность орто- и пара- положений по сравнению с бензолом и пониженную реакционную способность мета- положения. Примерно такие же относительные скорости можно ожидать и для нитрования, а это значит, что нитрование анизола дает лишь несколько частиц на миллион м- продукта. Это незначительное количество чрезвычайно трудно непосредственно определить в смеси продуктов.
Факторы селективности
Для количественной оценки селективности действия электрофила используют другой параметр – $Sf$ фактор селективности, который представляет собой логарифм отношения $\frac{fn}{fм}$. Так для реакций замещения в молекуле толуола:
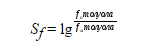
Этот фактор используют в тех случаях, когда имеется возможность определения величины $f_м$ для исходных молекул, в данном случае для толуола. Высокое значение $S_f$ так же как и высокое значение $f_n$ характерно для электрофильных агентов, которые проявляют очень высокуюе меж- и внутримолекулярную селективность. Низкое значение типично для электрофильных агентов с высокой реакционной способностью.













