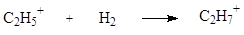Карбокатионы - активные частицы, несущие положительный заряд на одном или нескольких атомах углерода
Известны два вида карбокатионов - ионы карбению и карбония (ониевые катионы ).
Ионы карбения являются производными катиона $CH_{3^+}$, они могут образовываться при протонировании карбенов.
Химия карбениевих ионов разрабатывалась в работах Байера, Гомберга, Вальдена и Ганча (сначала по предложению Байера назывались карбониевыми ионами). Термин «ион карбения» введен Дильтеем 20 лет позже.
Ола предложил разделять понятия карбениевих и карбониевых ионов, причем термин «ионы карбония» относится к производным пентакоординацийных карбокатионов $CH_{5^+}$ (ион метонию). Они образуются за счет одноэлектронных трехцентровых связей, которые являются следствием $\sigma$-делокализации.
Карбкатионы с трехвалентным атомом углерода
$R_3C^+$ (трехкоординационные катионы); их называют карбениевые ионы, так как они образуются при протонировании карбенов:
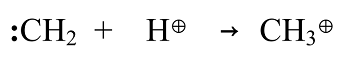
В катионах этого типа положительно заряженный атом углерода имеет на внешней оболочке $6$ электронов и, следовательно, находится в $sp2$-состоянии: все три атома, соединенные с ним $σ$-связями, расположены в углах правильного треугольника, в центре этого треугольника находится атом углерода, имеющий вакантную $p$-орбиталь, ось которой перпендикулярна плоскости треугольника.
Ониевые катионы
Ониевые катионы, получающиеся при присоединении протона к насыщенному атому углерода; их называют карбониевый ион (пентакоординационный катион):
Катионы этого типа - ониевые катионы - содержат пентакоординированный атом углерода. Известно очень мало представителей катионов этого типа. Предполагается, что ониевые катионы образуются как промежуточные продукты при реакциях электрофильного замещения при насыщенном атоме углерода и в процессах конденсации метана и других алканов. Катион $CH_{5^+}$, по-видимому, содержит двухэлектронную трехцентровую связь:

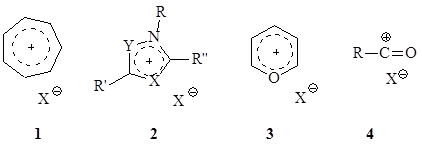
К ониевым катионам можно отнести протонированные циклопропаны ($I$) - частицы, промежуточно образующиеся при многих химических процессах:

Аренониевыми ионами (II) называют катионы, образующиеся при присоединении протона или другой катионоидной частицы к ароматическому ядру. В этом катионе атом, к которому присоединен протон, находится в $sp3$- гибридном состоянии.
Бромониевый катион (III) получается обычно наряду с карбениевым ионом при электрофильном присоединении брома к олефину. Бромониевый катион приводит к образованию транс-аддукта. Существование бромониевых катионов доказана получением стойких солей, например:
Неопределенные структуры
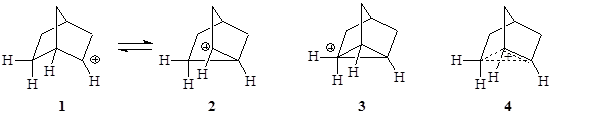
Некоторые структуры трудно отнести к определенному типу карбокатионов. Например, норборнил-2-катион, который можно представить как карбокатионы 1, 2 или пентакоординований катион 3. Иногда применяют делокализованных структуры типа 4.
Строение карбокатионов
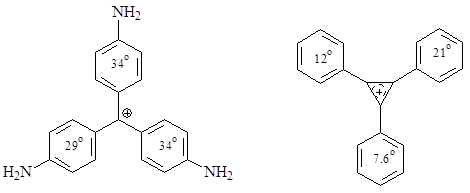
По данным РСА карбокатиоам характерна $sp2$-гибридизация центрального атома углерода с копланарнимы связями в карбениевого атома углерода и перпендикулярной вакантной орбиталью. Но ароматические ядра развернуты по отношению к основной плоскости. В трифенилметилперхлорате ароматические ядра расположены под углами приблизительно 30 градусов и образуют своеобразный пропеллер. Атомы хлора перхлорат аниона расположены выше и ниже центрального атома углерода на расстоянии 4.09 Å.
Для циклопропениевых циклов длина связи С-С - 1.37 Å. Катионы тропилия 1 (длина связи С-С - 1.47 Å), азолия 2, пирилия 3 построены аналогично. Катионы ацилию 4 линейные с сокращенными связями С = О (1.10-1.12 Å).
Электронная спектроскопия является одним из важных методов исследования карбениевих ионов, но интерпретация спектров требует быть осторожным, потому что карбокатионы могут реагировать с другими частицами, что есть в растворе. Иногда, особенно в растворителях с малой диэлектрической проницаемостью происходит взаимодействие катиона с анионом типа переноса заряда.
Электрические свойства карбокатионов
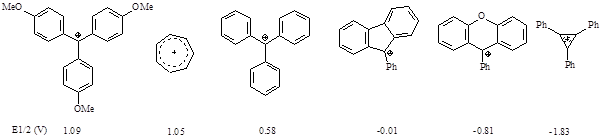
Полярографические потенциалы полуволн восстановления карбокатионов можно использовать для сравнения стабильности катионов и соответствующих радикалов.
Структура пентакоординованих ионов изучалась квантовохимическими методами.
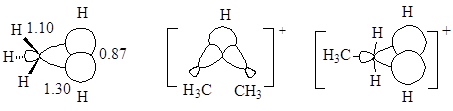
Ион метонию $CH_{5^+}$, который экспериментально наблюдался в масс-спектрах, имеет малосимметричное строение, так как при протонировании метана в реакции участвует главная доля гибридизованной $sр3$ орбитали (фронтальная атака). Расстояние $H^-$, согласно расчетам, почти в точности равно межпротонному расстоянию в молекуле водорода. Отсюда следует, что катион $CH_{5^+}$ можно рассматривать как комплекс кислоты $CH_{3^+}$ и $H_2$. Этим объясняется факт легкого расщепления $CH_{5^+}$ на $CH_{3^+}$ и $H_2$ Вследствие указанного явления в ионах метония возможные перегруппировки «от связи к связи», которые проявляются, например, при применении дейтериевой метки.
Структура пентакоординованого иона $C_2H_{7^+}$ представляется двух типов (вторая структура считается менее стабильной)
Ионы карбония являются интермедиатами в спектрометрических процессах фрагментации, анодной окислении насыщенных углеводородов в суперкислой среде.