Самой важной группой реакций для ароматических соединений являются реакции электрофильного замещения. Поскольку ароматическое кольцо притягивает электрофильные, а не нуклеофильные частицы, то реакции по этому проходят легко и широко используются как в лабораторном, так и в промышленном синтезе.
Данный процесс заключается в замещении одной электрофильной частицы (обычно - протона) другой электронно-дефицитной частью. В этой реакции используют разнообразные электрофильные реагенты обозначаемые символом $E^+$, и она является путем получения многих замещенных ароматических соединений. Более того, когда эту реакцию применяют к производным бензола, уже содержащим один или более заместитель, для процесса характерно явление региоселективности (специфичности и направленности замещения), а также выборочная реакционная способность, которые объясняются теорией.
Типы механизмов электрофильного ароматического замещения
Для электрофильного ароматического замещения предполагается два механизма идущих по альтернативным направлениям:
-
Первым вариантом механизма является механизм одностадийного бимолекулярного замещения типа $S_E2$. Согласно нему атаки электрофилов происходят синхронно с разрывами связей $C - H$:
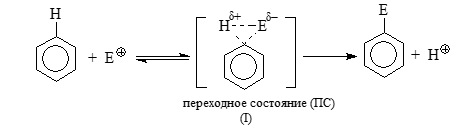
Рисунок 1. -
Вторым вариантом механизма является механизм двухстадийной реакции присоединения - процесс с отщеплением и промежуточным образованием аренониевых ионов, называемых σ-комплексами.
Механизм одностадийного бимолекулярного замещения типа $S_E2$
По данному механизму в конфигурация в ароматическом секстете $\pi$-электронов в ходе реакций сохраняется, и процесс замещения происходит путем взаимодействий НСМО электрофилов с ВЗМО связями ароматических соединей $C - H$:
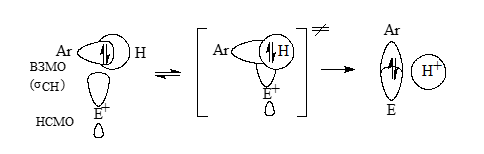
Рисунок 2.
В переходных состояниях образуются трехцентровые двухэлектронные связи между $C-H$ и теми атомами электрофилов $E^+$, на которых плотность НСМО велика. Образование трехцентровых переходных состояний $(I)$ не вызывает теоретических возражений. Двухэлектронные трехцентровые фрагменты в этих переходных состояниях изоэлектроннв ароматическим $\pi$-системам циклопропенильных катионов, которые ароматичны. Значит, переходные состояния $(I)$ будут «ароматичными», т. е. не слишком высокими по энергии.
Механизм SE-аренониевого электрофильного замещения
Второму механизму было дано название $S_E(Ar)$ - $S_E$-аренониевое электрофильное замещение. По этому механизму ароматичность и шестиэлектронная система в интермедиатах исчезает, они заменяются на нециклические четырехэлектронные сопряженные системы пентадиенильных катионов $(C=C-C=C-C^+)$, а на второй стадии ароматические системы вновь восстанавливаются в результате отщеплений протонов. Атака НСМО электрофилов происходит не на $\sigma$-орбиталям связей, а на $\pi$- ВЗМО, поэтому взаимодействия граничных МО можно представить в виде двух альтернативных схемам:
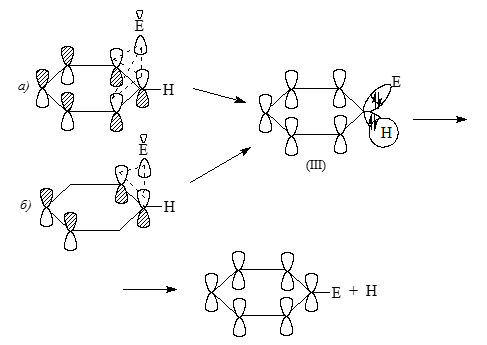
Рисунок 3.
Однако в монозамещенном бензоле $C_6H_5X$ вырождение снимается. Так например, в феноле или анилине ВЗМО имеют форму (а). Строение аренониевых ионов $(II)$ можно изобразить различными способами:
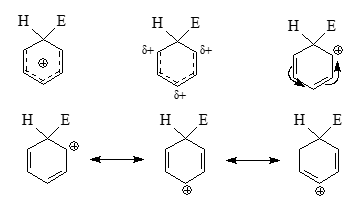
Рисунок 4.
Наиболее часто употребляют первую формулу, однако и другие приведенные схематические формулы также актуальны. Используя эти альтернативные формулы можно показать, что положительные заряды аренониевых ионов в основном находятся в орто- и пара- положении к геминальным узлам циклогексадиенильных катионов. И поэтому $\sigma$-комплексы будут стабилизироваться донорными заместителями, которые находятся в орто- и пара- положениих, гораздо лучше, чем донорными заместителями в мета- положении. Если переходные состояния медленных стадий электрофильного замещения похожи на аренониевые ионы, то (+М)-заместитель будет направлять электрофил в пара- и орто- положение, т. е. реакция будет региоселективной.












