В предыдущих темах было показано, каким образом на основе водородных атомных орбиталей можно объяснить строение двухатомных ионов. Точно так же поступают и при объяснении структуры двухатомных молекул. Сначала, основываясь на $МО$ иона $Н_2^+$, определяют $МО$ исследуемой двухатомной молекулы, а затем, пользуясь принципом Паули, заселяют эти $МО$ необходимым числом электронов. Рассмотрим электронное строение простых двухатомных гомоатомных молекул типа $X_2$.
Электронная конфигурация двухатомных молекул
На рис. 1 слева и справа показаны энергетические уровни атомов, а в центре - энергетические уровни молекул. Эта условная качественная диаграмма. На самом деле энергетические уровни имеют совершенно определенные значения для разных молекул и, если нужно их точно знать, они рассчитываются методом самосогласованного поля. Однако для выяснения электронной конфигурации молекул достаточно и этой качественной диаграммы.
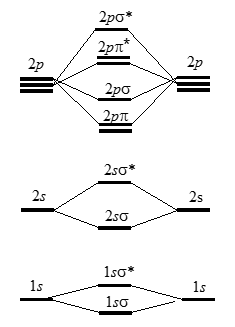
Рисунок 1. Энергии МО для гомоядерных двухатомных молекул элементов второго периода
Эту схему можно использовать для описания молекулы $Не_2$, но так как в этом случае имеется четыре электрона, разрыхляющая орбиталь также должна быть заселена. Поэтому между двумя ядрами не возникает связи, т. е. молекула $Не_2$ нестабильна. Из $р-АО$ также можно составить комбинации, являющиеся молекулярными орбиталями $δ$- и $\pi$-типов (рис. 2).
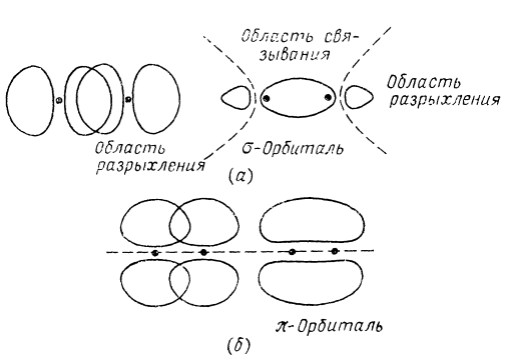
Рисунок 2. Образование $δ-$ и $\pi$-орбиталей при перекрывании $р-АО-а$ — образование $δ$-орбитали при перекрывании двух $р-АО$ концами; б — образование $\pi$-орбитали при боковом перекрывании двух $р-АО$
Диаграммы энергетических уровней двухатомных молекул
Для ряда простых двухатомных молекул можно использовать схему энергетических уровней, приведенную на рис. 3. Так, например, молекула азота, у которой 10 валентных электронов, имеет следующую конфигурацию:
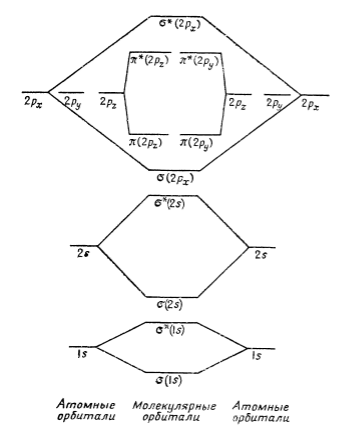
Рисунок 3. Упрощенная качественная диаграмма энергетических уровней для двухатомной молекулы, например, $N_2$
Поскольку участие $2δs$-электронов в образовании связи исключено присутствием двух электронов на разрыхляющей $δ^*$-орбитали, то эти две орбитали фактически эквивалентны двум несвязывающим парам электронов у каждого атома азота. В сумме получаем три связывающие пары электронов, т. е. возникает тройная связь. В молекуле кислорода добавляется еще два электрона, которые, очевидно, должны заселить пару вырожденных $δ^*$-орбиталей $2р$. Согласно правилу Гунда, электроны будут располагаться по одному на каждой орбитали и будут неспаренными. Это послужило объяснением парамагнетизма молекулы $O_2$ (рис. 4) и явилось одним из первых успехов метода молекулярных орбиталей. Таким образом, в молекуле кислорода кроме несвязывающих $2s$-электронов имеются еще три поделенные пары и два неспаренных разрыхляющих электрона.
Энергетическая схема $O_2$
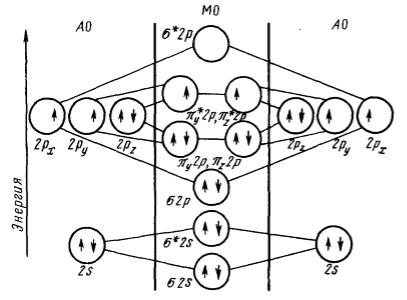
Рисунок 4. Энергетическая схема $АО$ и $МО$ в системе из двух атомов кислорода
Однако соотношение уровней энергий $МО$ может измениться даже в одном и том же периоде из-за взаимодействия электронов $МО$, у которых разница энергий не очень велика (рис. 5).
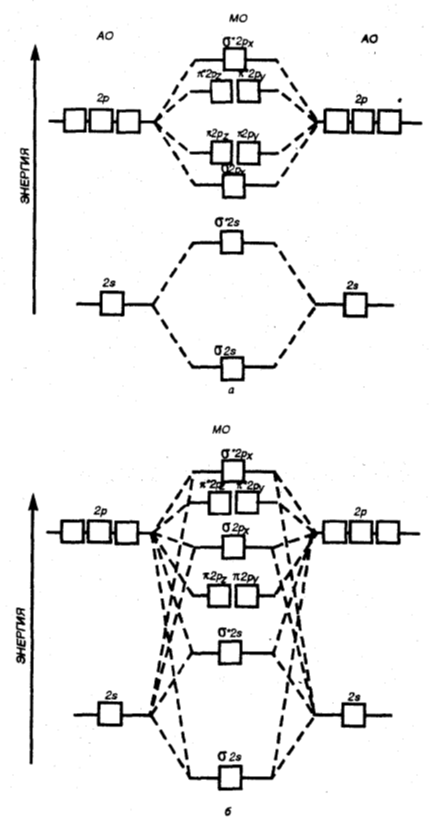
Рисунок 5. Диаграмма энергетических уровней $АО$ и $МО$ двугомоядерных молекул элементов от начала (до $N_2$) (а) и до конца (от $N_2$ до $F_2$) (б) второго периода












