Химикам известно около двух миллионов соединений, содержащих углерод, и всего около ста тысяч соединений, безуглеродных соединений. У очень большой части углеродосодержащих соединений имеются атомы углерода, связанные с четырьмя другими атомами, и в этих случаях углы между связями оказываются поразительно близкими к тетраэдрическому углу $109^\circ 28'$, или приблизительно $109,5^\circ$. Как можно объяснить характерное тетраэдрическое расположение четырех атомов вокруг атома углерода, основываясь на представлениях об атомных орбиталях?
$sp^3$-Гибридизация
Рассмотрим простейший случай - молекулу метана $CH_4$. В основном состоянии газообразный атом углерода, как известно, обладает электронной конфигурацией $1s^2$; $2s^2$, $2p^2$, причем одна из $р$-орбиталей остается свободной, а две другие содержат по одному электрону. Таким образом, орбитали углерода могут принять на себя еще четыре электрона. Поэтому и не удивительно, что существует молекула $CH_4$, так как каждый из четырех атомов водорода может поставить по одному электрону на орбитали углерода, перекрываясь с ними своей $1s$-орбиталью. Но какие же углы между связями следует предсказать для образующейся при этом молекулы $CH_4$?
Три $p$-орбитали, направленные под прямыми углами друг к другу, должны образовывать три связи, также расположенные под прямыми углами друг к другу.
Если бы четвертый атом водорода перекрывался $2s$-орбиталью углерода (обладающей сферической симметрией), то он мог бы занимать любое положение относительно атома углерода. Ясно, что, поскольку три положения на трех взаимно перпендикулярных осях заняты тремя другими атомами водорода, четвертый атом водорода скорее всего должен быть расположен где-то со свободной стороны атома углерода. Допустим, что этот атом водорода занимает положение, равноудаленное от трех остальных атомов водорода, которые перекрываются своими орбиталями с $p$-орбиталями атома углерода. Тогда молекула метана должна была бы иметь форму треугольной пирамиды. Три атома водорода, перекрывающиеся с $p$-орбиталями углерода, дали бы три связи под углами $90^\circ$ друг к другу, образующие равностороннее основание пирамиды. Четвертый атом водорода, перекрывающийся с $s$-орбиталью углерода, занимал бы вершину этой пирамиды и все прилегающие к ней грани представляли собой равнобедренные треугольники. Все четыре связи $C-H$ имеют одинаковую длину, энергию, частоту колебаний, полярность и расположены под одинаковыми углами друг к другу. Если они действительно образованы в результате перекрывания орбиталей атома углерода и четырех атомов водорода, каждое такое перекрывание должно быть совершенно идентично с тремя остальными.
Тетраэдрическое связывание атома углерода может быть исследовано методами квантовой механики, но и в этом случае нет необходимости проводить вычисления, чтобы понять ход рассуждений и выводы, к которым они приводят. Задача заключается в том, чтобы найти наиболее устойчивый набор орбита- лей, на которых можно разместить восемь электронов (четыре валентных электрона углерода и четыре электрона от четырех атомов водорода), исходя из наличия одной $2s$-орбитали и трех $2p$-орбиталей у атома углерода. Согласно опытным данным, в результате образуется набор из четырех идентичных связей, тетраэдрически располагающихся в пространстве. Разумеется, к такому же выводу приводит и квантовомеханическое рассмотрение. Этот новый набор из четырех идентичных и тетраэдрически расположенных орбиталей называется гибридизованной формой исходных $2s-$ и $2p$-орбиталей или, иначе, $sp^3$-гибридизованными орбиталями. Гибридизация орбиталей типа $sp^3$ обнаруживается не только в случае атома углерода. Аналогичная гибридизация позволяет объяснить наблюдаемые на опыте свойства большинства соединений с четырехкоординираванными атомами кремния, германия, олова, свинца и многих других веществ. Отличие между поведением углерода, с одной стороны, и поведением хлора, серы и фосфора, с другой стороны, заключается в том, что при образовании $HCl$, $H_2S$ и $PH_3$ все частично незаполненные орбитали имеют одинаковую симметрию - во всех этих случаях речь идет о $p$-орбиталях. Однако образование четырех связей углеродом требует комбинации свойств симметрии $p$- и $s$-орбиталей. В результате возникает тетраэдрическая $sp^3$- гибридизация.
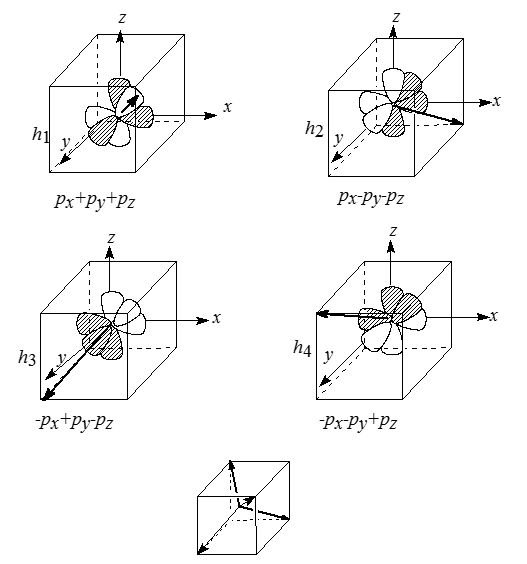
Рисунок 1. Пространственная направленность $sp^3$-гибридных атомных орбиталей
$sp^2$-Гибридизация
В молекуле этилена (этена) $H_2C=CH_2$ двойная связь $C=C$ состоит из одной $\sigma$-связи и одной $\pi$-связи. $\sigma$-Связь образуется боковым перекрыванием двух одинаково направленных р-орбиталей соседних атомов углерода, промотированных в состояние $1s^22s^2p^3$. Оставшиеся одна $2s$-орбиталь и две $2p$-орбитали дают три эквивалентные $sp^2$-гибридные орбитали, а если орбитали эквивалентны, они должны располагаться как можно дальше одна от другой, т.е. в одной плоскости под углом $120^\circ$.
Схема образования трех $sp^2$-гибридных орбиталей приведена на рис. 2, где при сложении $p$-орбитали рассматриваются как векторы.
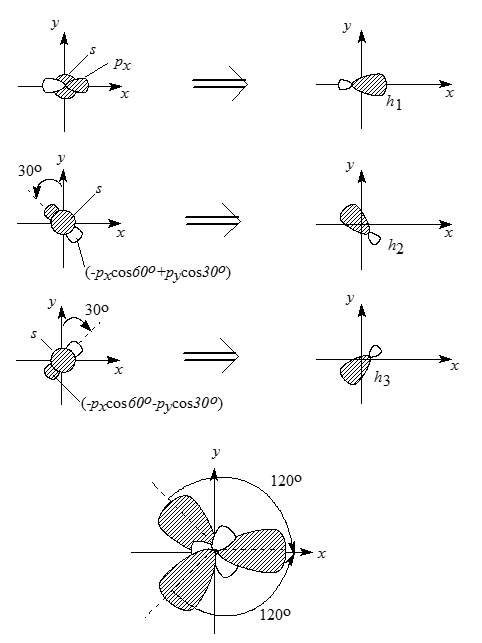
Рисунок 2. Образование $sp^2$-гибридных атомных орбиталей
Таким образом, молекулы этилена является плоской и ее двойная связь имеет электронную конфигурацию $\sigma^2 \pi^2$. Структура молекулы этилена приведена ниже:
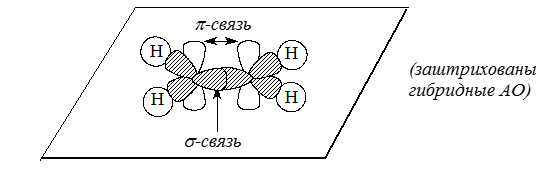
Рисунок 3.
Одним из экспериментальных доказательств именно такой структуры этилена является торсионная жесткость двойной связи, т.е. отсутствие свободного вращения вокруг $C=C$-связи. Это обусловлено тем, что при вращении одной метиленовой группы относительно другой уменьшается перекрывание $p$-орбиталей, т.е. ослабляется (а при повороте на $90^circ$ исчезает совсем) $\pi$-связь. В этилене энергия $\pi$-связи составляет $65 ккал/моль$ - это очень высокий барьер, препятствующий внутримолекулярному вращению.
$sp$-Гибридизация
Молекула ацетилена (этина) $HC \equiv CH$ еще более ненасыщена, чем этилен. Ее электронная структура описывается связыванием двух $sp$-гибридизированных атомов кглерода, каждый из которых имеет две перпендикулярные $p$-орбитали:
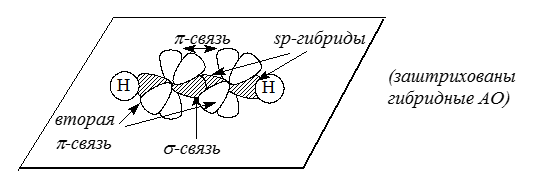
Рисунок 4.
$sp$-Гибридные $АО$ называются диагональными, они придают молекулам линейную форму.











