Химические свойства насыщенных углеводородов обусловлены наличием в их молекулах атомов углерода, водорода и связей $C-H$ и $C-C$.
В молекуле простейшего алкана метана химические связи образуют 8 валентных электронов (4 электрона атома углерода и 4 - атомов водорода), которые размещены на четырех связующих молекулярных орбиталях.
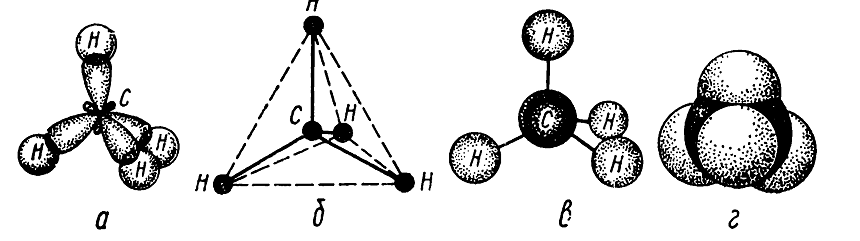
Итак, в молекуле метана из четырех $sp3$-гибридизированных орбиталей атома углерода и s-орбиталей четырех атомов водорода образуются четыре $sp3-s (C-H)$ ковалентные связи (рис 1.).
Молекула этана образуется из двух углеродных тетраэдров - одной $sp3-sp3 (C-C)$ ковалентной связи и шести $sp3-s (C-H)$ ковалентных связей (рис. 2).
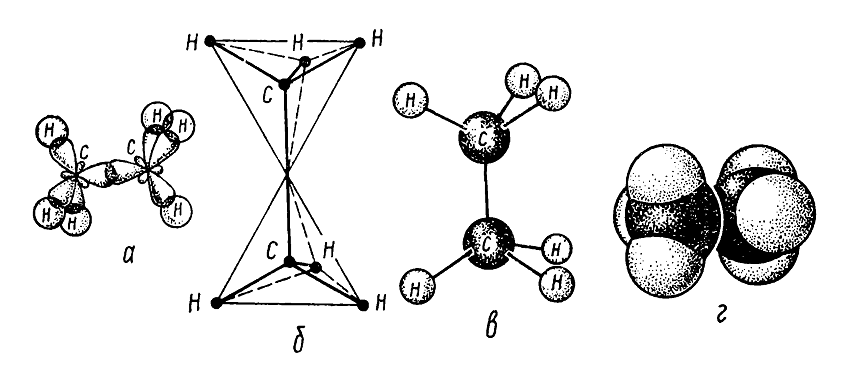
Рисунок 2. Строение молекулы этана: а - размещение $\sigma $-связей в молекуле; б - тетраэдрическое модель молекулы; в - шаростержневая модель молекулы; г- масштабная модель молекулы по Стюарту - Бриглебу
Особенности химических связей в алканах
В рассмотренных типах ковалентных связей области наибольшей электронной плотности находятся на линии, соединяющей ядра атомов. Эти ковалентные связи образованы локализованными $\sigma $-${\rm M}$${\rm O}$ и называются $\sigma $-связями. Важной особенностью этих связей является то, что электронная плотность в них распределена симметрично относительно оси, проходящей через ядра атомов (цилиндрическая симметрия электронной плотности). Благодаря этому атомы или группы атомов, которые соединены этой связью, могут свободно вращаться не вызывая деформации связи. Угол между направлениями валентностей атомов углерода в молекулах алканов составляет $109^\circ 28'$. Поэтому в молекулах этих веществ даже с прямой углеродной цепью атомы углерода в действительности размещаются не по прямой. Эта цепь имеет зигзагообразную форму, которая связана с сохранением межвалентных углов атомов углерода (рис. 3).
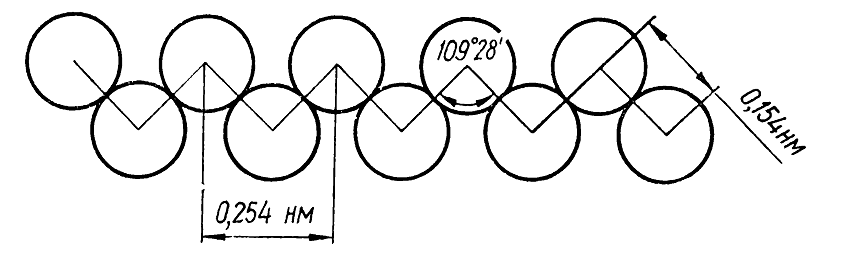
Рисунок 3. Схема строения углеродной цепи нормального алкана
В молекулах алканов с достаточно длинной углеродной цепью этот угол увеличен на $2^\circ$ вследствие отталкивания валентно не соединенных между собой атомов углерода.
Каждая химическая связь характеризуется определенной энергией. Экспериментально установлено, что энергия связи $C-H$ в молекуле метана составляет 422,9 кДж/моль, этана - 401,9 кДж/моль, других алканов - около 419 кДж/моль. Энергия связи $C-C$ равен 350 кДж / моль.
Взаимосвязь строения алканов с их реакционной способностью
Высокая энергия связей $C-C$ и $C-H$ обуславливает низкую реакционную способность насыщенных углеводородов при комнатной температуре. Так, алканы не обесцвечивают бромную воду, раствор перманганата калия, не взаимодействуют с ионными реагентами (кислотами, щелочами), не реагируют с окислителями, с активными металлами. Поэтому, например, металлический натрий можно хранить в керосине, который представляет собой смесь насыщенных углеводородов. Даже концентрированная серная кислота, которая обугливает много органических веществ, при комнатной температуре не действует на алканы. Учитывая сравнительно малую реакционную способность насыщенных углеводородов, их в свое время назвали парафинами. Алканы не имеют способности присоединять водород, галогены и другие реагенты. Поэтому этот класс органических веществ назвали насыщенными углеводородами.
Химические реакции насыщенных углеводородов могут происходить за счет разрыва связей $C-C$ или $C-H$. Разрыв $C-H$-связей сопровождается отщеплением атомов водорода с образованием ненасыщеных соединений или последующим замещением отщеплений атомов водорода другими атомами или группами атомов.
В зависимости от строения алкана и условий реакции в молекулах насыщенных углеводородов связь $C-H$ может разрываться гомолитично:
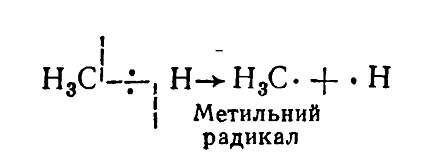
Рисунок 4. Химические свойства алканов
И гетеролитично с образованием анионов и катионов:
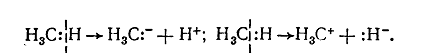
Рисунок 5. Химические свойства алканов
При этом могут образовываться свободные радикалы, имеющие неспаренный электрон, но не имеют электрического заряда, или карбкатионы или карбанионы, которые имеют соответствующие электрические заряды. Свободные радикалы образуются в качестве промежуточных частиц в реакциях радикального механизма, а карбкатионы и карбанионы - в реакциях ионного механизма.
Вследствие того, что связи $C-C$ неполярные, а $C-H$-связи - малополярные и эти $\sigma $-связи имеют низкую поляризуемость, гетеролитический разрыв $\sigma $-связей в молекулах алканов с образованием ионов требует большой затраты энергии. Гемолитическое расщепление этих связей требует меньше енергии. Поэтому для насыщенных углеводородов более характерны реакции, протекающие по радикальному механизму. Расщепление $\sigma $-связи $C-C$ требует меньшей затраты энергии, чем расщепление связи $C-H$, поскольку энергия $C-C$-связи меньше энергии $C-H$-связи. Однако химические реакции чаще происходят с расщеплением $C-H$-связей, поскольку они более доступны для реагентов.
Влияние разветвленности и размеров алканов на их реакционную способность
Реакционная способность $C-H$-связи меняется при переходе от алканов линейной структуры к алканам-разветвленной структуры. Например, энергия диссоциации связи $C-H$ (кДж / моль) при образовании свободных радикалов меняется следующим образом:
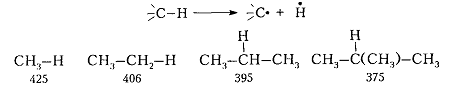
Рисунок 6. Химические свойства алканов
Кроме того, значение энергии ионизации (ЭИ) для алканов показывает, что рост общего количества $\sigma $-связей повышает их донорные свойства и отколоть электрон становится легче для соединений с большей молекулярной массой, например:
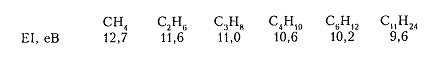
Рисунок 7. Химические свойства алканов
Итак, в свободнорадикальных процессах реакции происходят преимущественно у третичного атома углерода, затем у вторичного и в последнюю очередь у первичного, что совпадает с рядом устойчивости свободных радикалов. Однако с повышением температуры наблюдаемая тенденция уменьшается или совсем нивелируется.
Таким образом, для алканов характерны два типа химических реакций:
- замещения водорода, в основном по радикальному механизму и
- расщепление молекулы за связями $C-C$ или $C-H$.












