
Процесс поляризации
Поляризация - это процесс электростатического воздействия на частицу, в результате которого происходит смещение в ней электрических зарядов.
Процесс поляризации включает в себя с одной стороны поляризующее действие ионов, с другой - поляризуемость.
-
Поляризующее действие катиона. Зависит от электронной структуры иона, величины заряда и радиуса. Поляризующее действие будет тем значительнее, чем меньше радиус, главное квантовое число внешних электронных орбиталей и больше величина заряда.
Например: сильное поляризующее действие характерно катионам первых рядов Периодической системы.
-
Поляризуемость анионов. Зависит от тех же факторов, что и поляризующее действие катионов. Чем больше у аниона радиус и заряд, тем сильнее он поляризуется.
Поляризующее действие катиона заключается в оттягивании на себя электронного облака от аниона. В результате степень ковалентности увеличивается, ионность связи уменьшается, то есть связь становится ковалентной полярной.
Поляризация ионов по своему эффекту противоположна поляризации ковалентной связи.
Поляризуемость и ее свойства
Поляризуемость - способность вещества приобретать электрический дипольный момент под действием внешнего электрического поля. Это способность к деформации электронного облака частицы под действием электростатического поля другого иона. Поляризующее действие иона будет определять напряженность этого поля.
Поляризуемость характеризует способность молекулы становиться полярной в результате действия внешнего электрического поля. Соединение поляризуется также при действии молекул друг на друга, например, во время химических реакций.
Результатом поляризации может стать полный разрыв связи. При этом осуществляется переход связывающей электронной пары к одному из атомов и образуются разноименные ионы. Ассиметричный разрыв связи с образованием таких ионов называется гетеролитическим:
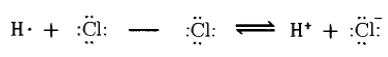
Рисунок 1.
Поляризуемость может быть вызвана:
-
смещением электронов или атомных ядер под действием электрического поля;
-
изменением геометрии молекулы;
-
поворотом молекулы;
-
смещением иона в соседнюю свободную кристаллографическую позицию (поляризуемость Сканави) и др.
Поляризуемость ионов зависит от электронной структуры иона, его заряда и размера. В каждой подгруппе периодической системы поляризуемость ионов элементов растет с увеличением их порядкового номера.
Поляризующее действие ионов тем значительнее, чем:
-
устойчивее электронная оболочка иона;
-
больше заряд;
-
меньше радиус иона.
Поляризуемость возрастает:
-
при увеличении размеров молекулы (атома);
-
с возрастанием атомного номера;
-
увеличении легкости возбуждения атома.
Например: Октан более поляризуем, чем гексан, так как имеет больше электронов. Но гексадиен тоже будет более поляризуем, чем гексан, что связано с наличием у гексадиена подвижных $\pi $-электроны. А $\pi $-электроны более чувствительны к изменению электрического поля, чем $\sigma $-электроны.
Поляризуемость влияет на:
-
кислотность и основность молекул в газовой фазе;
-
жесткость кислот и оснований Льюиса;
-
скорость нуклеофильного замещения.
Расчет поляризуемости молекул
Поляризация проявляется в возникновении индуцированного дипольного момента $\mu_{инд}$; у частиц (в результате смещения электронов и ядер).
Индуцированный дипольный момент является пропорциональным напряженности внешнего электрического поля:
$\mu_{инд} = \alpha \cdot \varepsilon_0 \cdot Е$,
где $\mu_инд$ - индуцированный дипольный момент, Д;
$\alpha $ -- коэффициент пропорциональности -- поляризуемость частицы, $\frac{Кл \cdot f {м^2}}{B}$;
$E$ -- напряженность электрического поля, $B$.
Для ионов поляризуемость пропорциональна кубу их радиуса.
В электрическом поле у полярной молекулы с постоянным дипольным моментом появляется еще индуцированный дипольный момент. Тогда учитывается суммарная относительная диэлектрическая проницаемость. Это выражается уравнением Дебая:
$N(\frac{\alpha + \mu^2}{3\varepsilon_0kT})=3(\varepsilon-1)(\varepsilon+2)$,
где $N$ - число молекул в единице объема образца;
$\alpha $ - поляризуемость молекулы;
$\varepsilon_0$ - постоянный дипольный момент молекулы;
$k$ - постоянная Больцмана;
$T$ - абсолютная температура.
Если построить график зависимости правой части этого уравнения от $\frac{1}{T}$, то
можно определить $\frac{\mu^2}{3\varepsilon_0k}$ и , следовательно, постоянный дипольный момент молекулы. Поляризуемость определяется по отрезку, отсекаемому на оси ординат при $\frac{1}{T} = 0$.
При очень высоких температурах диполь вращается так быстро, что его величина обнуляется и остается только индуцированный диполь. Он располагается в направлении индуцирующего его поля и может сохраняться при самых высоких температурах.
Влияние поляризации на свойства веществ.
Поляризуемость может объяснить некоторые особенности свойств веществ:
-
Растворимость.
Например: хлорид серебра $AgCl$ растворяется в воде намного хуже, чем хлорид натрия $NaCl$ или хлорид калия $KCl$. Радиус иона серебра $Ag^+$ соизмерим с радиусами ионов натрия $Na^+$ и калия $К^+$, но поляризуемость иона серебра гораздо больше (он имеет $18$ электронов на внешнем уровне), чем ионов натрия и калия. Поэтому межъядерное расстояние в хлориде серебра меньше, а энергия разрыва связи больше, чем в молекулах хлоридов натрия и калия.
-
Температура плавления. Взаимная поляризация ионов способствует разрушению кристаллов. При этом понижается температура плавления, и тем больше, чем сильнее деформируется кристаллическая решетка.
Например: В молекулах фторидов рубидия $RbF$ и титана $TiF$ радиусы катионов одинаковы, но ион титана $Ti^+$ сильнее поляризуется и поэтому оказывает сильное поляризующее действие на ион фтора $F^-$, чем ион рубидия $Rb^+$. Температура плавления фторида рубидия составляет $798^\circ C$, а т. пл. фторида титана $327^\circ C$.
-
Температура диссоциации. Процессу поляризации будет способствовать повышение температуры. При этом увеличивается амплитуда колебаний ионов, что иногда приводит к перестройке структура вещества. Наблюдается полиморфное превращение. При нагревании возможен и полный переход электронов от аниона к катиону -- происходит термическая диссоциация вещества. Чем сильнее будет поляризующее действие, тем ниже температура диссоциации.
Например: в ряду соединений данного катиона $MCl - MI$ и данного ниона $NaГ - LiГ$ температура разложения будет понижаться.











