Альтернантные углеводороды интересны тем, что их строения и реакционные способности подвергаются не сложному расчету.
Распределение электронов в альтернантных системах
В четных альтернантных углеводородах $\pi$-электроны равномерно распределяються по сопряженным системам, хотя на индивидуальных орбиталях распределения неравномерны.
В нечетных альтернантных углеводородах с их несвязующей МО (n$\pi$) распределение электронов определяют пользуясь методами Лонге-Хиггинса, развитыми Дьюаром. Данный расчет состоит в следующем:
-
расставляют звездочки в молекуле так, чтобы было помечено максимальное количество атомов;
-
для всех непомеченных атомов коэффициенты должны равняться нулю
-
суммы коэффициентов для всех помеченных атомов, окружающих непомеченные атомы, должны быть равными нулю;
-
для всей ИО $\sum C^2=1$ (нормировочное условие).
Бензильная система
Для иллюстрации этих правил можно рассмотреть бензильную систему:
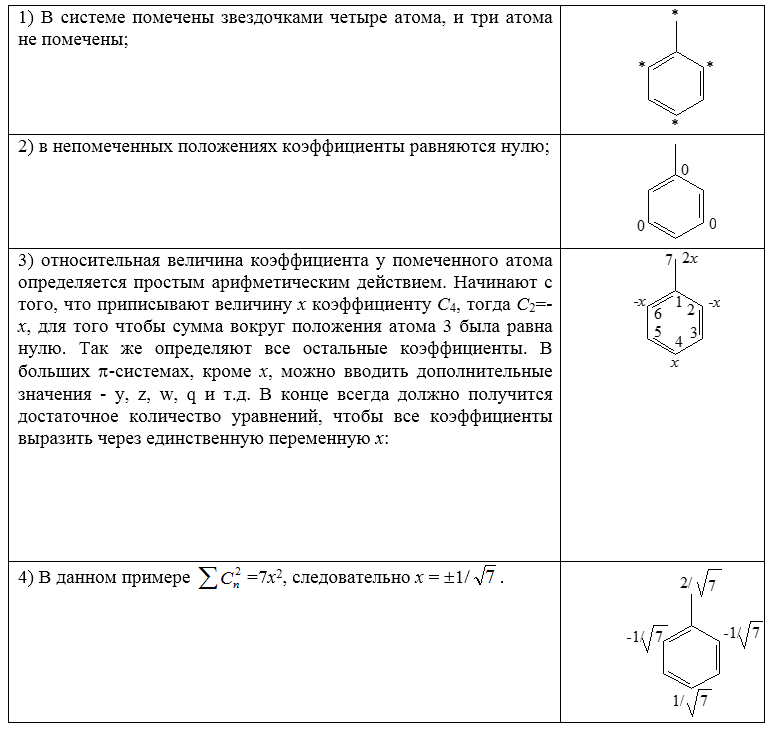
Рисунок 1.
Таким образом, бензильная несвязующая молекулярная орбиталь имеет вид
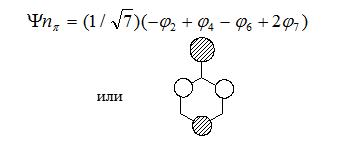
Рисунок 2.
В бензильной системе на этой орбитали находится всего один электрон (рис. 3).
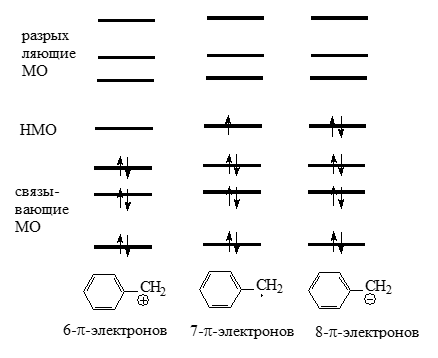
Рисунок 3. $\pi$-Орбитали бензильной системы
Суммарная (по всем занятым МО) $\pi$-электронная плотность на каждом атоме углерода равна единице. Для каждого атома суммы коэффициентов по всем МО:
$\sum C^{2} $(связующих) + $\sum C^{2} $(разрыхляющих) + $C^2(n_{\pi}) =1$.
Из условия парности (симметрии расположения орбиталей):
$\sum C^{2} $(связующих) =$\sum C^{2} $(разрыхляющих)
Электронная плотность равна:
$2\sum C^{2} $(связующих) + $C^2(n_{\pi}) =1$.
При ионизации бензильных систем путем отнятия электронов получаются катионы, в которых отсутствуют электроны, в радикалах находившийхся на $n_{\pi}$, т.е. $n_{\pi}$ будет иметь положительную «дырку» (рис. 1). Эти «дырки» будут распределены по молекулам, и поскольку связующие МО остаются заполненными, распределения положительных зарядов согласуется с величинами $C_n^2$ на каждом атоме.
В бензильных же анионах, в которых на n$\pi$ имеются вторые электроны, отрицательные заряды распределены в соответствии с квадратами коэффициентов, учитывающих вклад атомов в несвязующую орбиталь:
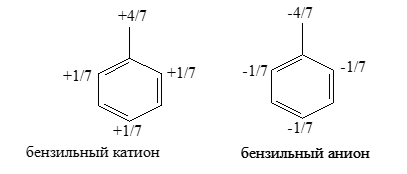
Рисунок 4.
Такие распределения зарядов в бензильных катионах и анионах соответствуют ($-M$)-эффектам групп $-CH_2$+ и ($+M$)-эффектам групп $-CH_2^-$.
Энергия делокализации
При образовании молекул бутадиена из пары молекул этиленовых фрагментов изменяетюс энергии, вследствие взаимных возмущений двух $\pi$-систем четных альтернантных углеводородов. Эти изменения энергий рассчитать не просто. Возмущения первого порядка между парами полностью занятых или парами пустых орбиталей не понижает общую энергию. Понижения энергий обусловлены относительно слабыми взаимодействиями второго порядка между связующими и антисвязующими орбиталями. Величины этих эффеков второго порядка для линейных $\pi$-систем не зависят от того, какие четные альтернантные углеводороды взаимно возмущаются. Можно добавлять, например, этиленовый фрагмент, и общие энергии каждый раз будут оставаться теми же.
Энергия делокализации у неальтернантных систем
Описанные выше методы можно использовать и для оценок энергий делокализаций неальтернантных систем. Так для примера, молекулы фульвена образовываются из пары аллильных фрагментов:
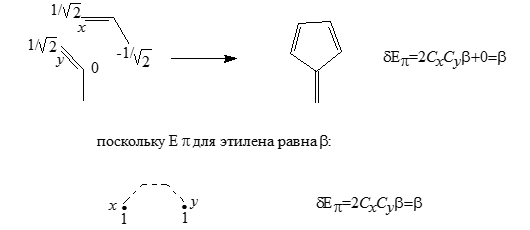
Рисунок 5.
Молекулы фульвена, содержащие по три сопряженных двойных связей, нисколько не стабильнее этилена.
С другой стороны, молекулы азулена немного стабильнее молекул ациклического декапентаена. Азулен проявляет ароматические свойства, хотя они менее выражены, чем у нафталина. Это иллюстрируется следующими расчетами:
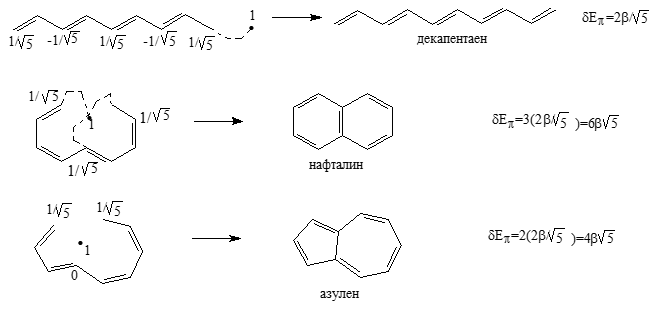
Рисунок 6.











