Для построения молекулярных орбиталей крупных молекулы проще всего воспользоваться методом «небольших строительных блоков».
Практическое применение качественной теории МО требует построения МО молекулы из орбиталей атомов или орбиталей ее отдельных фрагментов, что принято называть фрагментным (или реконструкционным) анализом (Р. Хоффман). Разделив молекулу на фрагменты таким образом, чтобы по возможности сохранить в каждом общие элементы симметрии, определяют их валентные орбитали и соответствующие энергетические уровни. Если молекула разделена на несколько фрагментов, можно составить ее МО, последовательно оценив все парные взаимодействия орбиталей фрагментов, а затем суммируя их тем же способом.
Составление двухатомной молекулярной системы АВ
Наиболее простой случай представляет молекулярная система $A-B$, разделяемая на фрагменты $A$ и $B$, взаимодействие между которыми сводится к взаимодействию только двух орбиталей.
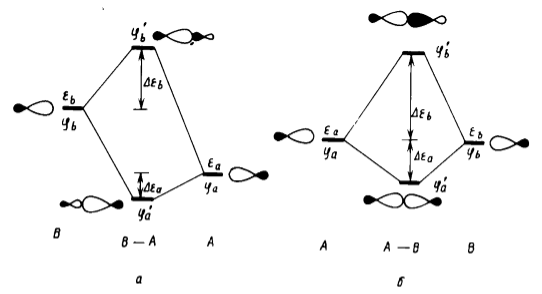
Рисунок 1. Образование МО системы $A-B$ из орбиталей фрагментов $A$ и $B$
Теория молекулярных орбиталей часто используется в качественной форме; при этом электроны размещаются по системам $\pi $-орбиталей так, как это было рассмотрено для случая бензола. Для полного изображения полученных представлений со всеми их компонентами требуется по меньшей мере художественное дарование, поэтому обычно наиболее тонкие детали опускают и переводят описание в терминах молекулярных орбиталей в графическую форму, используя простые структуры с пунктирными линиями аналогично тому, как это делается для резонансного гибрида. Для бензола это выглядит следующим образом:
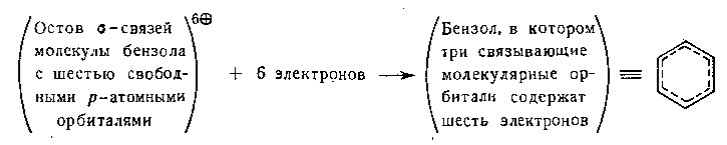
Рисунок 2.
Такой метод изображения содержит чрезвычайно мало информации и может, в сущности, привести к совершенно ошибочным выводам. Теория молекулярных орбиталей гораздо менее пригодна для качественного рассмотрения органических молекул, чем метод резонанса. Проиллюстрируем возникающие при этом трудности на двух различных примерах; следует подчеркнуть, что эти трудности возникают только при качественном рассмотрении.
Системы молекул в простых органических молекулах
Рассмотрим $\pi $-электронные системы бутадиена и триметиленметила, которые имеют одинаковую формулу $C_4H_6$ (рис. 3).
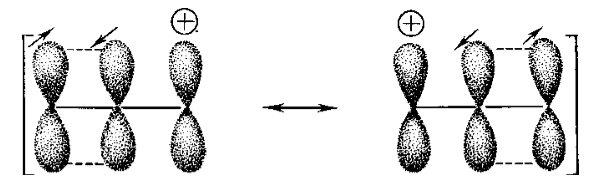
Рисунок 3. Атомно-орбитальные модели бутадиена-$1,3$ и триметиленметила
Если принять, что каждая система имеет четыре молекулярные орбитали, на которых размещены четыре «ненасыщенных» электрона, и провести далее пунктирные линии между соседними углеродами, то окажется, что нет причин, по которым эти два расположения существенно отличались бы друг от друга. С другой стороны, рассмотрение возможных схем спаривания электронов (по методу резонанса) сразу же приводит к выводу о том, что бутадиен должен быть резко отличен от триметиленметила (рис. 4).
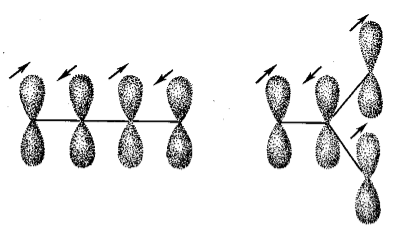
Рисунок 4. Схемы спаривания электронов в бутадиене-$1,3$ и триметиленметиле
Если на атоме углерода должен находиться в среднем один электрон и если каждый электрон должен быть спарен с электроном, находящимся на соседнем углеродном атоме, то триметиленметил будет представлять собой бирадикал. Более подробно рассмотрение триметиленметила по методу ЛКАО приводит аналогично простому методу резонанса к выводу, что это вещество должно быть бирадикалом; однако этот вывод трудно передать в качественной форме.
Трудности, связанные с качественным применением теории молекулярных орбиталей к простым системам, можно видеть также на хорошо известном примере аллил-катиона, который был рассмотрен ранее с помощью метода резонанса. В данном случае имеем я-систему из трех р-орбиталей и два электрона (рис. 5).
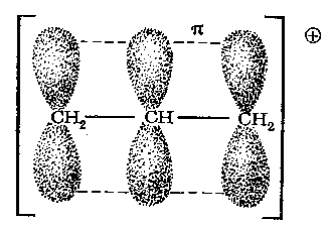
Рисунок 5. Атомно-орбитальная модель я-электронной системы алкил-катиона
Качественная картина молекулярных орбиталей предполагает, что два электрона распределены более или менее равномерно по трем орбиталям, причем, очевидно, на каждом углеродном атоме должен находиться частичный положительный заряд. Это не соответствует экспериментальным фактам (а также более подробному расчету по методу ЛКАО), из которых следует, что заряд расположен главным образом, если не целиком, на концевых атомах углерода. Метод резонанса сразу же дает правильную картину, поскольку две основные и эквивалентные схемы спаривания имеют заряд только на концевых атомах углерода (рис. 6).
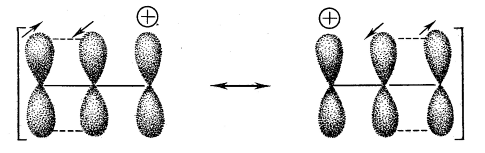
Рисунок 6. Схемы спаривания электронов в аллил-катионе












