Разбор молекул на составляющие части позволяет построить ее молекулярные орбитали в виде линейных комбинаций орбиталей составляющих. Решение о том, на какие части разделять данные молекулы, основываеться на картине взаимодействий орбиталей этих составляющих.
Пары орбиталей, направленные "через пространство" между составляющими молекул, комбинируются в фазах и в противофазах. Обычно комбинации в фазах имеют более низкие энергии, чем комбинации в противофазах. Однако в некоторых случаях комбинации в фазах могут лежать выше по энергиям, чем комбинации в противофазах.
Молекула $1,4$-диазабицикло[$2.2.2$]октана
Рассмотрим две неподеленные пары электронов, которые находяться в молекулах $1,4$-диазабицикло[$2.2.2$]октана - органического диамина. Прямые взаимодействия "через пространство" двух гибридных неподеленных пар электронов приводит к образованиям уровней $n_+$ и $n_-$, которые показаны на схеме:
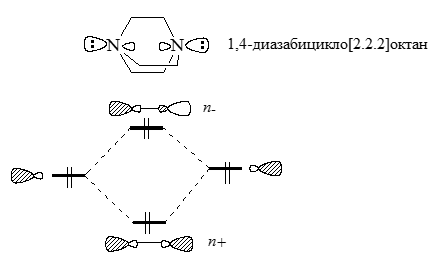
Рисунок 1.
Из-за того, расстояния между атомами $N$ велики, энергетические различия между $n_+$ и $n_-$ должны быть небольшими. Но расчет и данные эксперимента это не подтверждают. Двум первым полосам в фотоэлектронном спектре, обусловленым ионизацией уровней $n_+$ и $n_-$, соответствует расхождение больше чем на $2$ эВ ($7,52$ и $9,65$ эВ). При анализе колебательных спектров $1,4$-диазабицикло[$2.2.2$]октана было установлено, что уровни $n_+$ лежат выше уровней $n_-$. Такое расположение уровней обусловлено неподеленными электронными парами которые не правильно рассматривать отдельно от других составляющих системы. Эти пары взаимодействуют с $\sigma $ и $\sigma $-МО углерод- углеродных связей, которые находятся между атомами азота. Такие эффекты и называются взаимодействиями "через связь". МО $n_+$ и $n_-$ взаимодействуют с $\sigma $ и $\sigma $-орбиталями углерод-углеродных связей. По сравнению с $1,4$-взаимодействием неподеленных пар "через пространство" это $1,2$-взаимодействие ($n_+$ с $\sigma $ и $n_-$ с $\sigma $) выражено гораздо сильнее. Под влияниями орбиталей $\sigma $ и $\sigma $ энергии уровней $n_+$ повышаются, а энергии уровней $n_-$ - понижаются. Это приводит к сильному расщеплению уровней, что и отражается в спектрах.
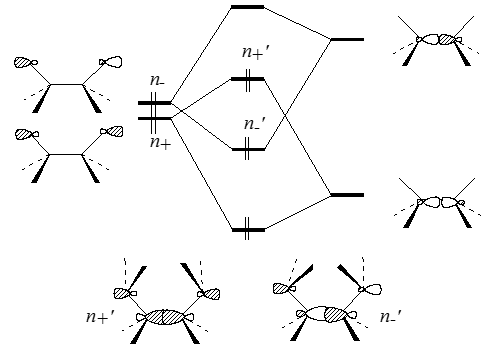
Рисунок 2. Орбитальные взаимодействия "через связь" в молекуле диазабициклооктана
Молекула пиразина
Пиразин ($1,4$-Диазин) $C_4H_4N_2$, бесцветное кристаллическое вещество с запахом, похожим на гелиотроп; перегоняется с водяным паром; хорошо растворимый в воде, спирте, эфире.
Многие производных пиразина встречается в природе: метоксипиразины входят в состав душистых веществ сладкого перца, гороха и других бобовых растений. Пиразин - гетероциклическое ароматическая соединение, которое проявляет слабые основные свойства; в водном растворе образует соль с одним эквивалентом минеральной кислоты, а при отсутствии воды - с двумя; с водой образует гидрат; с алкилгалогенидами - моноалкилгалогениды (при нагревании алкильный радикал переходит к атому углерода):
В молекулах пиразина наблюдается аналогичная $1,4$-диазабицикло[$2.2.2$]октану картина. В пиразине комбинации $n_+$ лежат на $1,72$ эВ выше по энергии, чем комбинации $n_-$ :
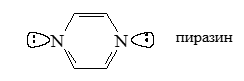
Рисунок 3.
Конкуренция между разными видами взаимодействий
Конкуренция между взаимодействием "через связи" и "через пространство" часто показывает очень интересные результаты. В качестве примера можно рассмотреть трицикло-$3,7$-октадиен - соединение которое может существовать или в анти-, или в син-конфигурации:
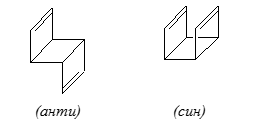
Рисунок 4.
В анти-структурах взаимодействием $\pi$-орбитали двойной связи "через пространство" можно пренебречь. Но исходя из данных фотоэлектронной спектроскопии, различия между первыми и вторыми потенциалами ионизаций для анти-форм $(\Delta IP=0,97$ эВ) больше, чем для син-форм ($0,36$ эВ). В анти-форме разнесенные двойные связи, взаимодействуют между собой лучше, чем в син-форме, где они находятся рядом.
Этот парадокс объясняется взаимодействием "через связи". Как показано на рис. 5, взаимодействие "через пространство" в транс-изомере очень мало, и уровень $\pi_+$ лежит лишь немного ниже уровня $\pi_-$.
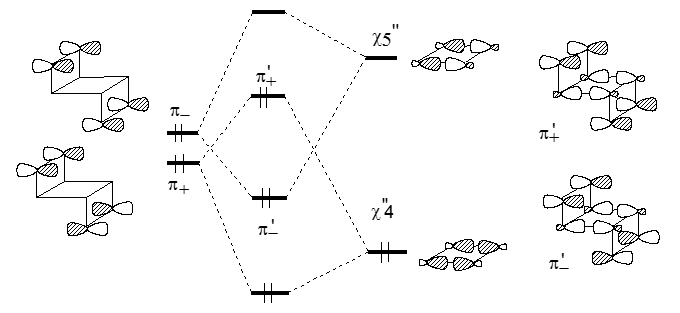
Рисунок 5. Диаграмма взаимодействия в анти- изомерах трицикло-3,7-октадиена
С уровнями $\pi_+$ и $\pi_-$ по симметрии могут взаимодействовать орбитали $\chi_4$"($\chi_3$") и $\chi_5$"($\chi_6$") соответственно. Вследствие взаимодействий "через связи" ($\pi_+ - \chi_4$") и ($\pi_- -\chi_5$") уровни $\pi_+$ и $\pi_-$ сильно расходятся и меняются местами. В цис-форме взаимодействия "через пространство" выражены гораздо сильнее, и расщепление уровней $\pi_+$ и $\pi_-$ гораздо больше (рис. 6), причем, как и для транс-формы, уровень $\pi_+$ лежит ниже уровня $\pi _-$ .
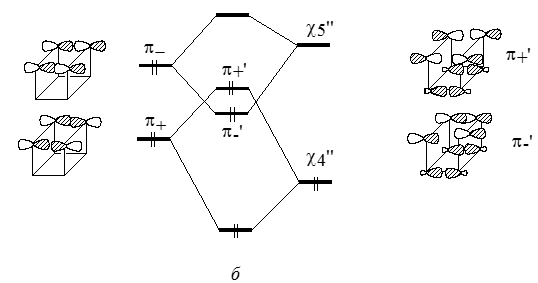
Рисунок 6. Диаграмма взаимодействия в син-форме трициклооктадиена












