При построении системы молекулярных орбиталей, образованных атомами разных элементов, следует пользоваться значениями их потенциалов ионизации $I$ (или ЭО) при размещении исходных атомных орбиталей на различных уровнях. Чем выше потенциалы ионизации элемента, тем относительно ниже энергетические уровни, соответствующие орбиталям атома.
Так как $I_F >I_H$ (энергия $1s$-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора -- $2p$-орбитали), то $2p$-орбитали фтора отвечают меньшему энергетическому уровню, чем $ls$-орбитали водорода. Взаимодействие $1s$-орбитали атома водорода и $2p$- орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы $HF$, образуют полярную ковалентную связь.
Вследствие еще большего различия в энергиях $ls$-орбитали водорода и $2s$-орбитали фтора не комбинируются. Также не комбинируются $2p_y$- $i$ $2p_z$- орбитали фтора с $1s$-орбиталью водорода из-за их различной симметрии относительно оси связи. Таким образом, $2s-$, $2p_y$- и $2p_z$-орбитали фтора переносятся без изменения в молекулу $HF$ и их считают несвязывающими молекулярными орбиталями. Тогда МОсв и МОразр образуются из $ls-$ орбитали водорода и $2p_x$-орбитали фтора.
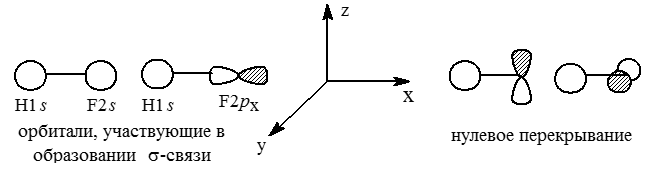
Рисунок 1.
Таким образом, в образовании одной связи $H-F$ должны участвовать три орбитали: $H1s$, $F2s$ и $F2p_x$.
По оскольку энергия ионизации фтора больше энергии ионизации водорода, то $2p$-орбитали фтора отвечают меньшему уровню энергии, чем $1s$-орбитали водорода. Из-за большого различия в энергиях $1s$-орбитали водорода и $2s$-орбитали фтора не комбинируются. Из-за различной симметрии относительно оси связи орбитали $2p_y$ и $2p_z$ атома фтора также не комбинируются с $1s$-орбиталью водорода.
Верность построения системы молекулярных орбиталей зависит от правильности выбора атомных орбиталей (с учетом возможности их гибридизации), способных комбинироваться в молекулярные орбиталями.
Диаграмма молекулярных орбиталей $H-F$ приведена на рис. 1.
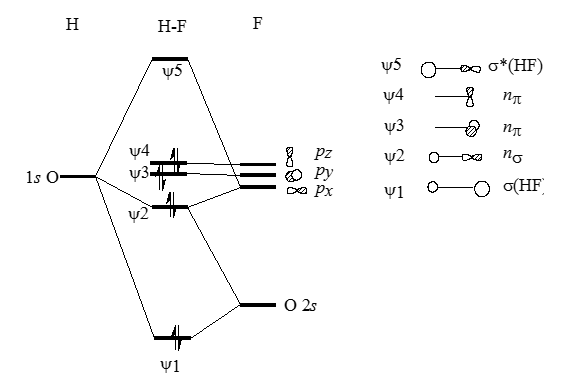
Для связывающей орбитали молекулы $HF$ $2p-$ орбиталь атома фтора играет более важную роль, чем $1s$-орбиталь атома водорода.
Для разрыхляющей орбитали молекулы $HF$ наоборот: $1s$-орбиталь атома водорода играет более важную роль, чем $2p-$ орбиталь атома фтора.
Число электронов на связывающих орбиталях равно $2$, на разрыхляющих - $0$, следовательно, порядок связи равен $1$. Электроны на несвязывающих орбиталях практически не вносят вклада в образование связи и не учитываются при оценке порядка связи.
Связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома, разрыхляющие -- ближе к орбиталям менее электроотрицательного атома. Различие в энергии исходных атомных орбиталей~ определяет полярность связи.
Схемы образования молекулярных орбиталей HF
Самая нижняя связывающая МО $\psi \ 1$ по энергии ближе всего к $F2s$-орбитали, поэтому и по форме должна быть похожей на $F2s$. Она образуется возмущением $2s$-орбитали водорода под влиянием $1s$-орбитали водорода возмущенной $2p_x$-орбиталью фтора:
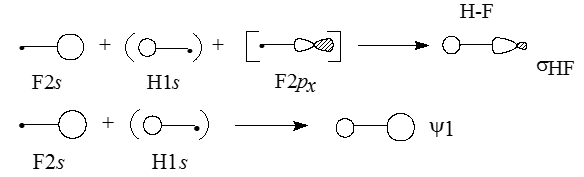
Рисунок 3.
разрыхляющая орбиталь $\psi \ 5$ в основном принадлежит водороду:
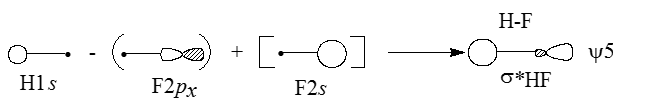
Рисунок 4.
Пренебрегая последним членом, получим:
орбиталь $\psi \ 2$ - это орбиталь атома фтора, возмущенная $1s$ -орбиталью атома водорода с небольшим участием $2s$ -орбитали атома фтора:
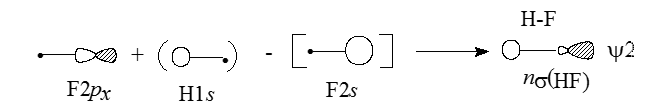
Рисунок 5.
Главное возмущение орбитали $F2p_x$ обусловлено близко расположенной по энергии орбиталью $H1s$, поэтому $\psi \ 2$ можно изобразить в следующей форме:
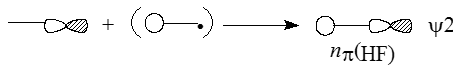
Рисунок 6.
Рассмотрев молекулу $HF$, можно составить общую схему для орбитальных связей и молекулярных орбиталей молекулы общей структуры $HX$. Они коррелируют между собой следующим образом:
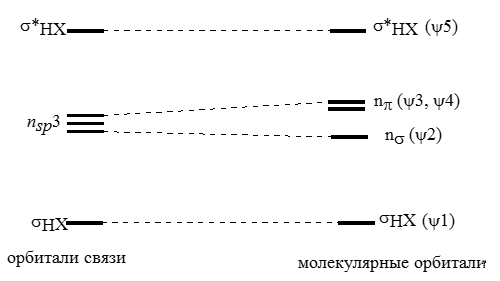
Рисунок 7.
Эквивалентные описания молекулы HF
Для молекулы $HF$ также возможны два эквивалентных описания: через орбитали связи $H-F$ и несвязывающие $sp^3$-гибридные «неподеленные пары» и через делокализованные молекулярные орбитали:

Рисунок 8.
Линейная молекула $HF$ имеет большой дипольный момент. Это объясняется тем, что энергия двух электронов на связывающей $1s^2p_x$ МО ближе по энергии к соответствующей АО фтора, чем к АО водорода, а также наличием заселенных электронами несвязывающих МО в поле ядра атома фтора. Этот вывод согласуется с разностью электроотрицательностей атомов фтора и водорода.












