Фенильная группа характеризуется наличием сопряженной системы р-орбиталей электронов атомов углерода, составляющих эту группу (рис. 1).
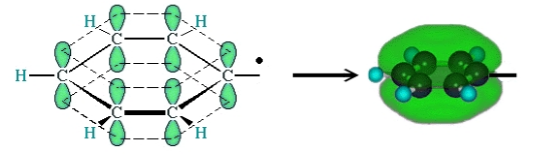
Рисунок 1. Схема делокализации $\pi$-электронов в фенильном радикале
Донорно-акцепторная двойственность фенила
Поскольку фенильная группа $C_6H_5$ и другие подобные группы, несущие сопряженную $\pi $-систему электронов, содержит только атомы углерода и водорода, т.е. атомы элементов с низкой электроотрицательностью, то такие заместители могут выступать как в роли доноров, так и в роли акцепторов $p$-электронной плотности. Например, в трифенилметильном катионе фенильный радикал выступает как донорный заместитель, а в феноксид-анионе - как акцептор $p$-электронной плотности от анионного центра (рис. 2).
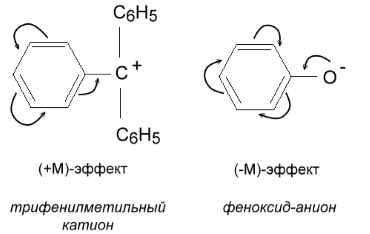
Рисунок 2. Донорно-акцепторная двойственность фенильного радикала
Донорно-акцепторная двойственность электроотрицательных заместителей
Большинство заместителей в органических соединениях содержат электроотрицательные атомы (азот, кислород, серу и другие). В случае, когда электроотрицательный гетероатом, имеющий неподеленную пару электронов, непосредственно связан с сопряженной системой, проявляется положительный мезомерный эффект. В противном случае, когда электроотрицательный атом связан двойной связью с атомом, не имеющим неподеленной пары электронов, проявляется отрицательный мезомерный эффект.
Группы типа $-NH-CR=O$ характеризуются положительным мезомерным эффектом благодаря наличию неподеленной пары электронов на атоме азота, однако этот эффект проявляется в меньшей степени, чем у группы $NR_2$ вследствие сопряжения неподеленной пары электронов с карбонильной группой. В качестве примера можно привести пара-ацетиламинотрифенилметильный катион. В этом катионе $p$-электронная плотность менее смещена в сторону положительного центра, чем в пара-аминотрифенилметильном катионе (рис. 3).
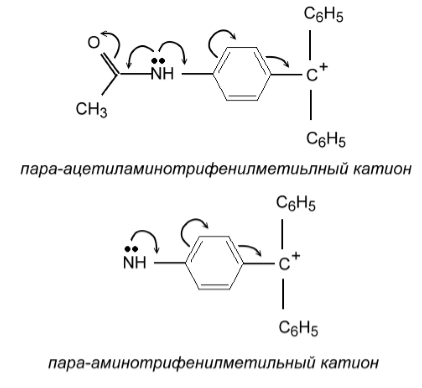
Рисунок 3. Донорно-акцепторная двойственность электроотрицательных заместителей
Двустороннее сопряжение в ацетиламинопроизводном называется кросс-сопряжением.
С формальной точки зрения любой заместитель обладает как положительным, так и отрицательным мезомерным эффектом даже в случае, когда один из этих эффектов очень мал или равен нулю. Другими словами, знак мезомерного эффекта рассматриваемого заместителя зависит от ближайшего окружения этого заместителя в органической молекуле.
Мезомерный эффект галогенов. Электронное строение галогенов
Прежде чем рассматривать влияние галогенов на смещение электронной плотности в органической молекуле, необходимо подробнее остановиться на электронном строении самих галогенов. На валентном слое атомов галогенов в основном состоянии находится $7$ электронов: электронная конфигурация $ns^2np^5$. Соответственно, эти атомы являются акцепторами электронов при образовании химической связи. Радиус соответствующих ионов увеличивается с ростом порядкового номера, а электроотрицательность - уменьшается (табл. 1).
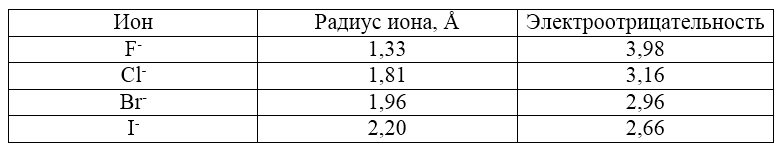
Рисунок 4. Характеристики галогенов
Особенности электронных эффектов галогенов
Известно, что мезомерные эффекты галогенов относительно малы. При этом фтор в пара-положении проявляет слабый электронодонорный эффект, а другие галогены - слабый электроноакцепторный эффект.
Исходя из предпосылок, приведенных в предыдущем разделе, галогены должны проявлять положительный мезомерный эффект, так как они имеют неподеленные пары электронов, одна из которых сопряжена с $\pi $-системой остальной части молекулы. Теоретически $p$-донорная подвижность этой пары должна:
-
с одной стороны, уменьшаться с ростом электроотрицательности атома;
-
с другой стороны, увеличиваться от йода к фтору поскольку фтор - элемент того же периода (второго), что и углерод, и кислород, и поэтому для фтора перекрывание $p-p$-типа эффективнее.
Забегая вперед, отметим, что второй фактор подвижности преобладает над первым.
На деле, отрицательный мезомерный эффект, теоретически возможный для пара-галогенозамещенных фенолят-ионов, может проявляться только для тяжелых галогенов, например, йода (рис. 5):
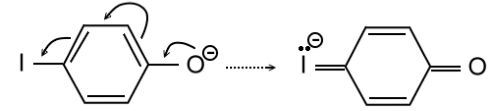
Рисунок 5. Пара-хиноидная предельная структура
Дело в том, что йод имеет относительно низкоэнергетические свободные $p$-орбитали и поэтому может расширять свою валентную оболочку до десяти электронов. Напротив, для фтора отрицательный мезомерный эффект или очень мал, или равен нулю, поскольку его свободные орбитали (например, $3p$) лежат слишком высоко и поэтому не заселяются. Таким образом, по теоретическому отрицательному мезомерному эффекту галогены можно расположить в ряд: $I > Br > Cl >> F$.
Мезомерные эффекты галогенов действуют на фоне сильных индуктивных эффектов этих заместителей. От тонкого их баланса и зависит экспериментально наблюдаемое изменение скорости или положения равновесия в рассматриваемой реакции. По этой причине (наложение эффектов) электронные эффекты в группе галогенов меняются «неправильным» образом. В случае менее электроотрицательных заместителей ($-NR_2$, $-OR$) отрицательный индуктивный эффект меньше и одновременно возрастает способность к положительному мезомерному смещению электронной плотности. Отрицательными мезомерными эффектами этих заместителей второй группы Периодической системы можно пренебречь.












