Основные понятия и определения
Индуктивным эффектом называется смещение электронной плотности химической связи вдоль $\sigma $-связей. Это явление характерно для органических соединений. Возникновение смещения электронной плотности в молекуле органического соединения обусловлено наличием дипольного момента у этой молекулы, т.е. присутствием в ее составе заместителей, электроотрицательность которых отличается от электроотрицательности атома углерода. Различают положительный $+I$- эффект и отрицательный $-I$-эффект. В первом случае электронная плотность смещается в сторону заместителя, во втором - от него (рис. 1). Характерной особенностью индуктивного эффекта является его быстрое затухание по мере удаления от заместителя.
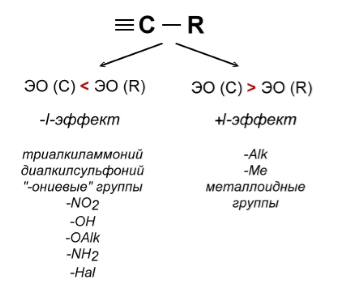
Рисунок 1. Знак индуктивного эффекта
Дипольный момент молекулы может рассматриваться с двух точек зрения:
-
общий дипольный момент как векторная сумма диполей отдельных связей;
-
молекула как система нескольких фрагментов, поляризующихся в поле, создаваемом диполем полярной группы.
Первый подход удобен при оценке наличия дипольного момента у симметричных молекул и их несимметричных изомеров (рис. 2).
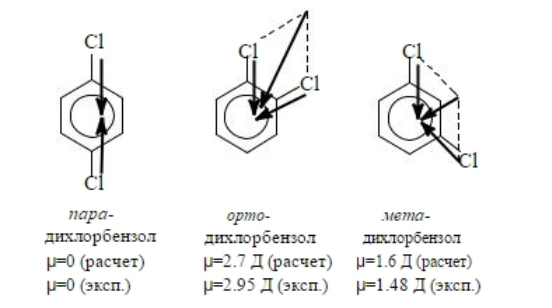
Рисунок 2. Дипольный момент изомеровдихлорбензола
Однако рассчитанные таким образом значения дипольных моментов могут существенно отличаться от экспериментально определенных, что связано с внутримолекулярным взаимодействием полярных групп, которое выражается в увеличении дипольного момента с увеличением размеров алкильной группы.
Индуктивный эффект
В основе теории Льюиса лежит предположение, что электроны в молекуле смещаются не поодиночке, а парами. Рассмотрим молекулу н-пропилхлорида (рис. 3). Из-за большого заряда ядра атома хлора электронная пара $\sigma $-связи $C-Cl$ смещена к атому хлора. Таким образом, атом хлора несет частичный отрицательный заряд, а атом углерода, непосредственно соединенный с атомом хлора, - частичный положительный заряд. Этот же атом углерода притягивает электронные пары соседнего атома углерода, не связанного с атомом хлора. Таким образом, атом хлора вызывает последовательное смещение электронных пар $\sigma $-связей по всей молекуле. На рис. 3 это явление схематично изображено стрелками.
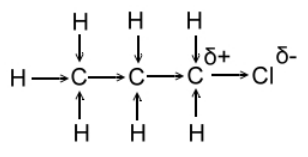
Рисунок 3. $H$-пропилхлорид
Такая способность электроотрицательного заместителя воздействовать на $\sigma $-электронные пары вдоль цепочки атомов углерода в органических молекулах и называется индуктивным эффектом. Следствием этого явления является возрастание дипольного момента органических молекул одного гомологического ряда по мере роста длины углеводородной цепи:

Рисунок 4.
Представление об индуктивном эффекте объясняет, почему происходит изменение констант скоростей и равновесий при введении в молекулу какого-либо полярного заместителя.
Эффект поля
При рассмотрении эффекта поля учитывается пространственное строение органической молекулы и диэлектрическая проницаемости среды, в которой эта молекула находится. В данном случае взаимное влияние частичных электрических зарядов функциональных групп молекулы передается по кратчайшему расстоянию между ними. Рассмотрим это явление на примере молекулы 2-хлорэтиламина (рис. 5). Атом хлора создает частичный положительный заряд на связанном с ним атоме углерода. В результате неподеленная электронная пара атома азота в соответствии с законом Кулона смещается в сторону этого атома углерода, что, в свою очередь, снижает основность аминогруппы.
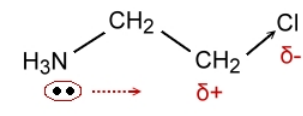
Рисунок 5. 2-хлорэтиламин
В большинстве случаев индуктивный эффект и эффект поля действуют в одном направлении. Поэтому отделить один эффект от другого очень трудно и их часто рассматривают совместно. Комбинацию индуктивного эффекта и эффекта поля называют полярным эффектом. Однако используют и простой термин «индуктивный эффект», подразумевая, что в это понятие включается и индуктивный эффект Льюиса, и эффект поля.












