Для объяснения кратных (двойных и тройных) связей в квантовой химии введено новое понятие «$\pi $-связь». Она отличается от $\sigma $-связи тем, что получается в результате перекрывания индивидуальных собственных $\psi $-функций двух атомов, направления максимальных значений которых (и. следовательно, оси симметрии бесконечного порядка гантелеобразных электронных облаков) перпендикулярны к линии соединения атомов. В обычных ординарных связях, т. е. $\sigma $-связях, максимум обоих связывающих функций лежит на одной линии, соединяющей атомы. Однако в случае $\pi $ -связи картина совершенно меняется:
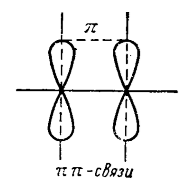
Рисунок 1.
максимальнее перекрывание возможно в том случае, если связывающие функции параллельны друг другу и находятся на одной, плоскости.
Как было объяснено выше, при образовании тригональных связывающих функций $sp2$-гибридизации, три гибридные связывающие функции находятся на одной плоскости, допустим на плоскости, образуя между собой углы в $120^\circ$. Перпендикулярно этой плоскости вдоль оси $z$ ориентируется четвертая направленная валентность, обусловленная кегибридной собственной $\psi $-функцией. Причина и сущность образования кратных связей между атомами вообще и между углеродными атомами в частности состоит в том, что одна из кратных связей всегда представляет собой $\sigma $-связь, которая образуется одной тригоиальной собственной функцией каждого атома, а остальные связи (вторая в случае двойной связи, и вторая и третья в случае тройной связи) представляет собой $\pi $-связи, которые возникают в результате взаимного перекрывания двух (в случае двойной связи) или четырех (в случае тройной связи) индивидуальных функций, ориентированных перпендикулярно к плоскости тригоиальных функций и, следовательно, к линии соединения атомов. Форма электронных облаков и расположение $\sigma $- и $\pi $ -- связей напрямую коррелирует с молекулярными $\pi $-орбиталями.
Минимально сопряженные системы
Сопряженная система могжет быть линейной или циклической. Минимально сопряженные системы состоят из трех $p$- орбиталей. К ним относятся:
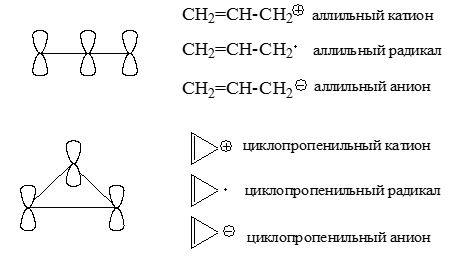
Рисунок 2.
Четырехатомные ${\mathbf \pi }$-системы
Четырехатомным $\pi $-системам соответствуют:
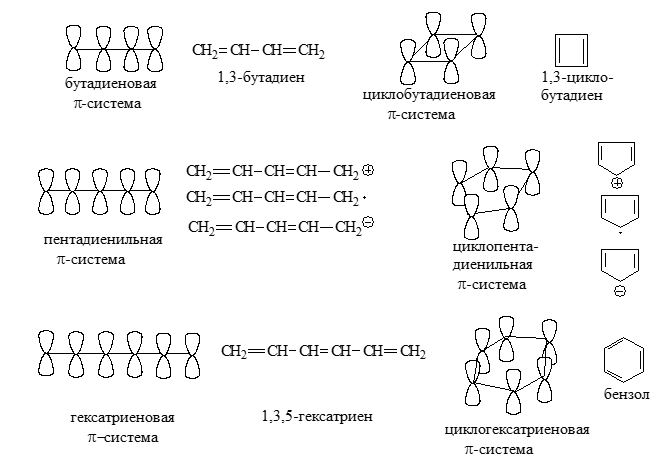
Рисунок 3.
В нейтральных сопряженных углеводородах, в которых каждый атом углерода четырехвалентный, содержиться четное число атомов, имеющие $p$- орбиталь. Нечетная сопряженная система представляет собой катион, радикал или анион, т.е. содержит трех координационный атом.
Простые ${\mathbf \pi }$-системы
В качестве самой простой $\pi $-системы можно рассмотреть одиночную атомную р- орбиталь в метильном элементе. При объединении двух $p$- орбиталей, образуются этиленовые $\pi $-системы, состоящие из связывающих и разрыхляющих орбиталей.
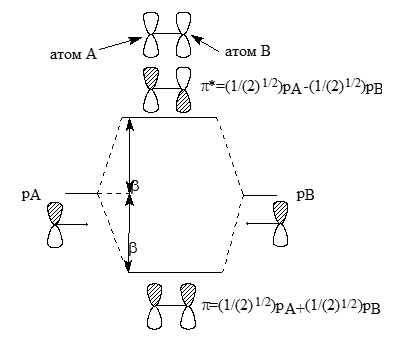
Аналогично молекуле этилена можно построить $\pi$-МО простейших сопряженных систем. При этом рассматривают возмущения в системе двух орбиталей этилена ($\pi$ и $\pi$*) и одиночной $p$-АО. Образование аллильных систем изображено на рис. 5.
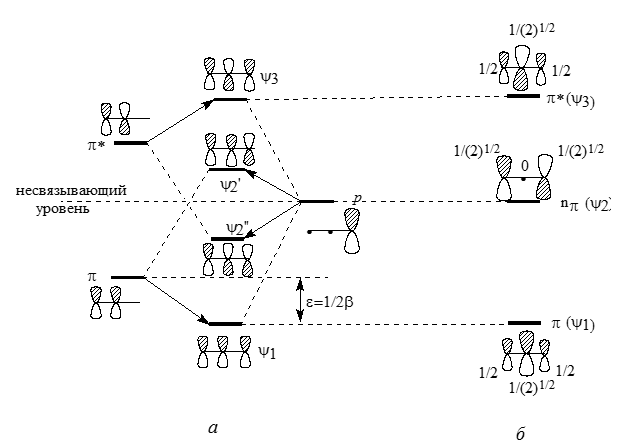
Рисунок 5. Построение (а) и истинные (б) $\pi $-орбитали аллильного элементу
При возмущениях второго порядка $\pi $ МО, взаимодействет с $p$ орбиталью, что дает орбиталь $\psi1$, и в противофазе дает $\psi2'$. Орбиталь $\pi $*, взаимодействуя в орбиталью $p$, в фазе дает орбиталь $\psi2''$ , а в противофазе - орбиталь $\psi3$.
$\pi $-Систему иклопропенила можно представить в виде результата взаимодействий одиночных $p$- атомных орбиталей с одновременным взаимодействием по обоим концам $\pi $-орбиталей этиленового типа. Это справедливо только для связывающей $\pi $- молекулярной орбитали, так как разрыхляющая не подходит под пару по симметрии.
Следовательно, $\pi $*- орбиталь не будет возмущаться:
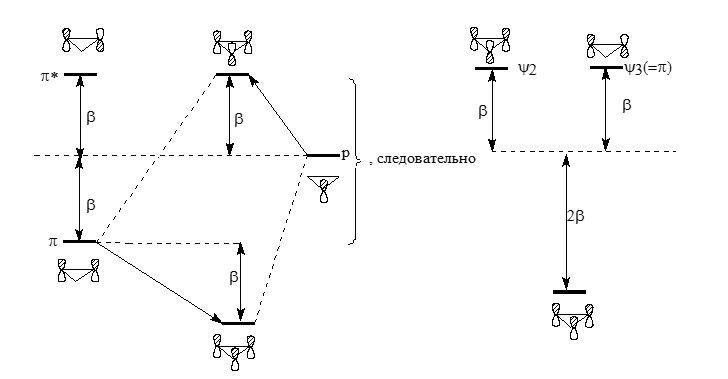
Рисунок 6.












