Представление об электромерном или мезомерном эффекте в теоретической форме отразило то обстоятельство, что двойная связь не является жестко фиксированной, строго локализованной системой, что облако $\pi $-электронов подвижно, динамично охватывает все атомы, связанные сопряжением. В то же время $\pi $-электронам присущи некоторые черты $\pi $-связи, им свойственен, в частности, индукционный сдвиг. Возникает вопрос: насколько строго локализованы сами $\sigma $-электроны, не присущи ли им черты электромерного эффекта?
Бейкер и Натан изучали реакцию кватернизации пиридина замещенными бромистыми бензилами:
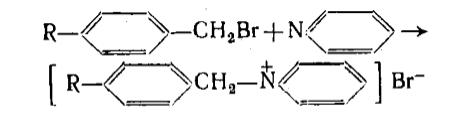
Рисунок 1.
Скорость реакции есть функция поляризации связи $C-Br$: чем легче атом брома может отщепиться, тем быстрее идет реакция. Алкильные группы осуществляют $+I$-эффект, который возрастает в ряду
$CH_3
Поскольку $+I$-эффект должен содействовать отщеплению аниона брома, то скорость реакции должна расти симбатно изменению $+I$-эффекта в указанном ряду. Эксперимент выявил обратный характер зависимости. Этот факт оказался не единичным. Была изучена и такая реакция:
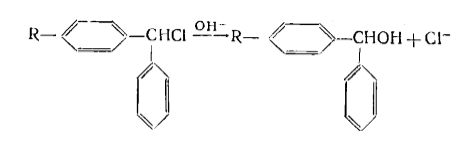
Рисунок 2.
Поскольку хлор отщепляется в форме аниона, то для упомянутого ряда алкильных заместителей $R$ должен наблюдаться рост скорости отщепления. Фактически скорость реакции изменяется следующим образом:
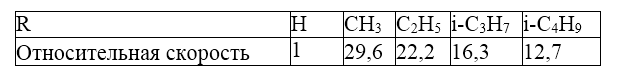
Рисунок 3.
Объяснение эффекта гиперконъюгации
Объяснение этой аномалии, названной эффектом Натана-Бейкера, предложил Коулсон. На низшем энергетическом уровне электроны в метильной группе образуют $\sigma $-связи. При этом имеются незанятые орбитали с более высокой энергией, в которой распределение электронов похоже на состояние с $p$-орбиталями. Если в метильной группе появляется такой возбужденный $p$-электрон, то он может вступить в сопряжение с $\pi $-электронами бензольного кольца, что уменьшит общую энергию молекулы. Если это уменьшение превышает затрату энергии на возбуждение электрона, то получается некоторый выигрыш энергии. Схематично это можно изобразить электромерным сдвигом в метильной группе:
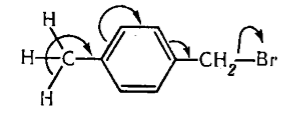
Рисунок 4.
Данное явление может быть названо $\sigma $-, $\pi $-сопряжением или гиперконъюгацией (сверхсопряжением). Поскольку электроны связей $C-H$ переходят на $p$-орбиталь, формально можно рассматривать метальную группу по аналогии с тройной связью ацетилена и констатировать в толуоле квази-$\pi $-$\pi $-сопряжение:
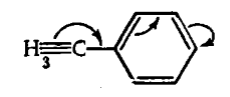
Рисунок 5.
Поскольку по мере замещения водородов метальной группы алкильными радикалами возможность $\sigma $-$\pi $-сопряжения уменьшается, то становится понятным эффект Натана --- Бейкера. Сверхсопряжение объясняет ориентирующее влияние метильной группы в молекуле толуола, который по электрофильному механизму замещается в орто- и пара-положения.
Объяснение гиперконъюгации согласно методу МО
Метод ВМО позволяет просто объяснить многие химические явления. в том числе и гиперконъюгацию. Рассмотрим этильный катион $CH_3CH_2^+$. Согласно классическим электронным представлениям, в этом катионе должен проявляться эффект гиперконъюгации, заключающийся в смещении $\sigma$-электронов связи $C-H$ к катионному центру:
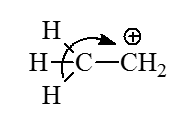
Рисунок 6.
Расположим этильный катион в плоскости $\sigma$ так, чтобы атомы углерода, а также $H_3$, $H_4$ и $H_5$ находились в этой плоскости, атом $H_1$ - сверху плоскости, а атом $H_2$ - снизу (рис. 7,а).
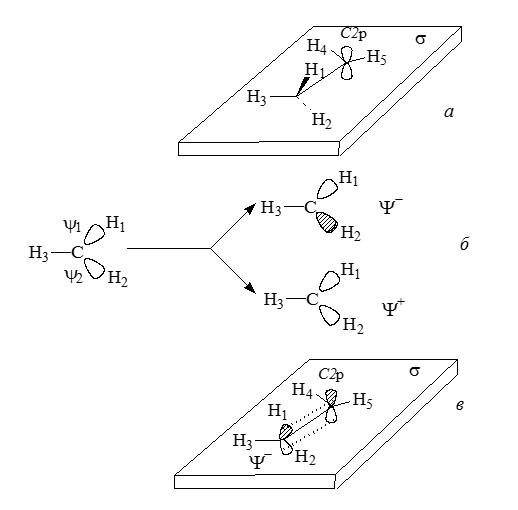
Рисунок 7. Гиперконъюгация в этильном катионе: а - расположение катиона в плоскости $\sigma$; б - образование симметризованных (делокализованных) $\sigma$-орбиталей из связывающих орбиталей локализованных $\sigma$-связей; в - взаимодействие делокализованной занятой орбитали $\Psi$- с $p$-орбиталью соседнего атома углерода
В теории молекулярных орбиталей термина "гиперконъюгация" нет, тем не менее возмущение, показанное на рис. 7,в, эквивалентно гиперконъюгации. Метильная группа, связанная с катионным центром, должна понижать энергию катиона, и действительно, по экспериментальным данным катион $CH_3CH_2^+$ стабильнее, чем $CH_3^+$.












