
Донорная связь
При образовании обычных ковалентных связей некоторые элементы (кислород, азот, фосфор, сера) используют не все внешние валентные электроны. У них на гибридных и негибридизованных орбиталях есть одна или более неподеленная электронная пара.
При взаимодействии заполненной двухэлектронной атомной орбитали такого гетероатома, который выступает донором пары электронов, с вакантной орбиталью атома с недостатком электронов -- акцептор электронной пары, образуется новая ковалентная связь.
Донорно -- акцепторная (координационная) связь -- это ковалентная связь, образованная за счет электронной пары одного атома.
Донорно -- акцепторная связь возникает в результате взаимодействия аминов с протонами кислот. Два электрона атома--донора в одинаковой степени относятся двум связанным атомам. В результате атом--донор приобретает положительный заряд. Появившаяся ковалентная связь (например, в ионе алкиламония), по свойствам будет идентична другим связям $N-H$, отличие состоит только в способе образования связи:
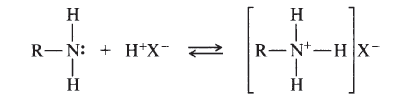
Рисунок 1.
В результате образуется соль алкиламмония. Подобные «ониевые» соли появляются если донором пары электронов выступают атомы фосфора, серы, кислорода. Роль катиона могут выполнять протон, карбокатион, атом углерода, имеющий дефицит электронной плотности.
Образующаяся по донорно -- акцепторному механизму связь $C-S$ в триметилсульфонийбромиде не отличается от других ковалентных связей $C-S$:
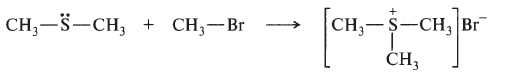
Рисунок 2.
К донорно- акцепторному типу относятся связи в комплексных соединениях.
В таких соединениях донором пары электронов выступают:
-
гетероатом с неподеленной электронной парой ($n$-доноры);
-
$\pi $-электроны изолированной $\pi $-связи или системы $\pi $-связей ,
Роль акцепторов выполняют:
-
ионы металлов, содержащие вакантные оболочки;
-
молекулярные бром, иод (за счет расширения валентной оболочки);
-
электронодефицитные $\pi $-системы (соединения, в которых $\pi $-система или $\pi $-связь обеднены электронной плотностью в результате акцепторного влияния заместителей).
Бензол-ион серебра (А), диоксан-триоксид серы (Б), металлоцены - $\pi $-комплексы ароматического циклопентадиенид-иона с ионами переходных металлов $(Co^{2+}, Fe^{2+}, Ni^{2+})$. В ферроцене $(B)$ взаимодействие двух колец циклопентадиенид-ионов с ионом железа происходит в результате перекрывания связывающих $\pi $- молекулярных орбиталей богатых электронной плотностью колец с вакантными $3d$ атомными орбиталями иона $Fe^{2+}$
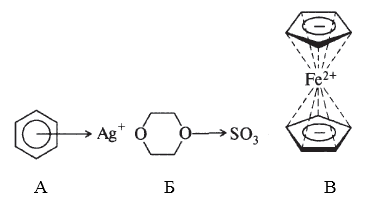
Рисунок 3.
Образование донорно -- акцепторных комплексов. Трансанулярный эффект
При образовании донорно -- акцепторных комплексов действуют силы, способные сблизить молекулы на расстояние , которое меньше ван-дер-ваальсовыхрадиусов. Если одно соединение имеет пустую низко находящуюся орбиталь, а другое соединение -- заполненную несвязывающую орбиталь, то между ними возможно взаимодействие, в результате которого появляются прочные комплексы:
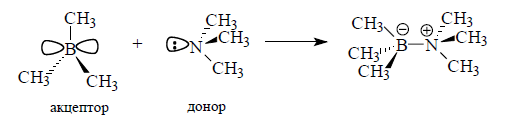
Рисунок 4.
Так как органическое соединение с ковалентной связью имеет занятые (связывающие и несвязывающие) молекулярные орбитали, возникновение донорно -- акцепторных комплексов становится общим явлением.
Появление комплекса между двумя первоначально кинетически независимыми молекулами связано с уменьшением энтропии. Следовательно, возможно, что донорно -- акцепторное взаимодействие будет достаточно большим, если донорная и акцепторная группы расположены внутри одной молекулы и в результате особенностей молекулярной структуры сближены на расстояние, необходимое для осуществления такого взаимодействия.
Такой тип внутримолекулярного взаимодействия называется трансаннулярным эффектом.
Трансаннулярный эффект встречается у элементоорганических соединений атранов со связями типа $N: >M$, где $M=B$, $Si$ и др.
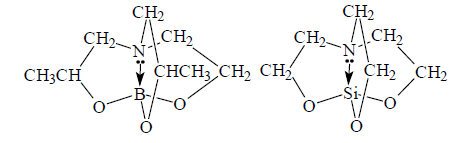
Рисунок 5.
В соединениях баратран и силатран донорно -- акцепторная связь показана стрелкой, направленной от азота к бору и от азота к кремнию. Структура молекул не является полностью цвиттерионной, содержащей фрагмент $N^+-M^-$, то есть связь не полностью ковалентная. Переход пары электронов от азота к атому элемента М является неполным. Поэтому донорно -- акцепторные комплексы называют комплексами с переносом заряда (КПЗ).
КПЗ можно наблюдать спектрально, когда в результате фотовозбуждения происходит полный перенос заряда. Если раствор смеси донора и акцептора в видимом или ультрафиолетовом спектрах дают новую полосу, отсутствующую в спектрах растворов донора и акцептора, которые сняли порознь (полоса переноса заряда), то это служит доказательством образования комплекса с переносом заряда.
При донорно -- акцепторном взаимодействии перенос заряда возможен только при тесном сближении донора и акцептора. Электроны переходят от донора к акцептору в результате перекрывания пустой орбитали акцептора с заполненной орбиталью донора. Между донором и акцептором в области перекрывания происходит «делокализация».
Донорно -- акцепторное взаимодействие характерно для $\pi $-систем, электроны которых способны легко поляризоваться, а орбитали с легкость проникают одна в другую.
Сопряжение кратных связей является боковым донорно -- акцепторным взаимодействием, которое ведет к переносу заряда, то есть к делокализации.
В результате донорно -- акцепторного взаимодействия образуются $\pi $-комплексы.
Семиполярная связь
Семиполярная связь является разновидностью донорно -- акцепторной связи. Атом -- донор образует связь с нейтральным атомом, у которого не хватает двух электронов для завершения внешней оболочки.
Семиполярная связь образуется в $N$-оксидах при взаимодействии аминов с пероксидом водорода. Атом азота дает свою пару электронов для образования связи с атомом кислорода. Происходит перераспределение электронной плотности. На связанных атомах появляются разноименные заряды:
\[R_3\ddot{N}+H_2O_2\to R_3N^+-O^-+H_2O\]В результате взаимодействия третичного амина с пероксидом водорода образуется $N$-оксид третичного амина.
Семиполярная связь является совмещением ковалентной и ионной связей. Ее характерный признак -- наличие противоположных зарядов на ковалентно связанных атомах.











