Молекулы циклопропана можно представить как состоящие из трех метиленовых систем ("строительных блоков"). Каждая из этих систем имеет МО, используемые для образования связи $C-H$ (на схеме не показаны), и, кроме того, $n_{\sigma^-}$ и $n_\pi$-орбиталей, которые используются для образований скелетных связей $C-C$:
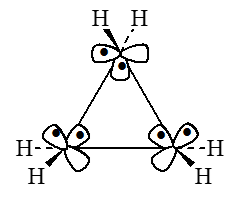
Рисунок 1.
Орбитали циклопропана
$n_\pi$-Орбиталь по энергии расположена немного выше $n_\sigma$ -орбитали. Форма скелетной плоскостной орбитали и алгоритм их построения, включающий объединение пары атомов с последующим присоединением третьего атома углерода, это показано на рис. 2. Расщепления уровней (рис. 2,а) соответствуют общим правила, согласно которым самую низкую энергию имеют $\sigma $-орбиталь, а самые высокие энергии - орбитали $\sigma*$-типа; между которыми располагаются $\pi-$ и $\pi*$-МО.
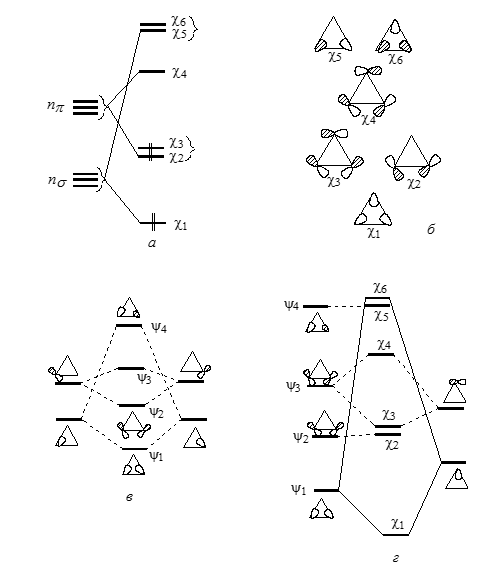
Рисунок 2. Расщепления $n_{\sigma^-}$ и n$\pi $-МО при образовании скелетной плоскостной орбитали циклопропана (а); форма МО (б) и последовательные стадии построений МО цикла (в и г)
Более строгая форма скелетных циклопропановых МО получается при учете факта, что у МО $\chi$5 и $\chi$6 наблюдаеться та же симметрия, что и МО $\chi$2 и $\chi$3. Следовательно, они смешиваются друг с другом по конфигурациям, как показано на схеме ниже:
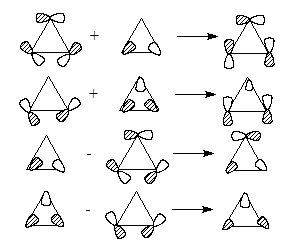
Рисунок 3.
МО циклопропана не имеют четко выраженных направлений вдоль межъядерных линии $C-C$, и связей $C-C$ поэтому называются "банановыми".
Такие орбитали были рассмотрены в предидущей главе.
Плоскостные -МО (рис. 2, б) соответствуют трем $C-C$-связям циклов, и каждой из связующих МО $\chi$1, $\chi$2 и $\chi$3 заняты парами электронов. МО $\chi$2 и $\chi$3 лежат выше, чем, например, обычные $\sigma_{cc}$-орбитали в этане. Эти МО почти целиком построены из $p$- орбиталей атомов углерода, которые лежат в плоскостях циклов. Эти $р-$ орбитали в отличие от циклопарафинов с большим размером цикла направляються друг к другу не по линиям С-С-связи. И так, уровень $\chi$2 как и $\chi$3, должны проявлять электронодонорные свойства в отношении заместителей в трехчленных циклах. По этим же причинам $\chi$4 ($HCMO$) должны проявлять электроноакцепторные свойства. Три углерод- углеродные связи в циклопропане практически эквивалентны, поскольку МО в паре $\chi$2-$\chi$3 заняты.
Влияние заместителей
Орбитали $\chi$2 и $\chi$3 по-разному взаимодействуют с заместителем в кольцах. Для примера в диметил-циклопропильном карбокатионе более стабиленой являеться конформация (А), чем в конформация (Б), при этом барьеры вращений между этими формами очень высоки. Эти факты легко объясняются взаимодействиями карбокатионных р-орбиталей с циклопропановыми орбиталями $\chi$3:
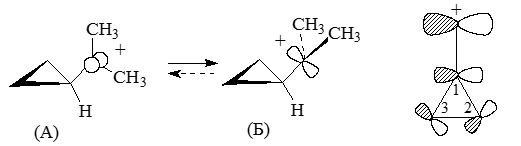
Рисунок 4.
Результатами таких взаимодействий является ослабление связи $C(1)-C(2)$ и $C(1)-C(3)$ и наоборот усилений связей $C(2)-C(3)$ в замещенных циклопропанах, которые содержат акцепторные заместители. Это выражается в удлинении связи $C(1)-C(2)$, как и связи $C(1)-C(3)$ и укорочении связей $C(2)-C(3)$. Типичным примером будет соединение:
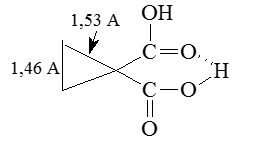
Рисунок 5.
По аналогии, можно рассмотреть положения равновесий норкарадиена -- гептатриена, которое сдвигаеться к норкарадиену при наличии акцепторного заместителя или нескольких:
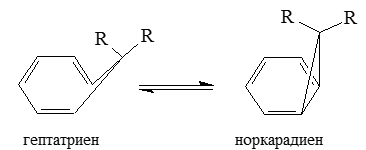
Рисунок 6.
Циклопропильные фрагменты норкарадиена стабилизируются акцепторными группами. Если на месте заместителя будет стоять водород, то соединений будут существовать только в циклогептатриеновых формах. Но если на месте заместителя будет стоять $CN$ группа, равновесие будет сдвинуто в сторону норкарадиена.
МО $\chi$2 (вторая вырожденная ВЗМО) отвечает за протонирование циклопропана "по ребру":
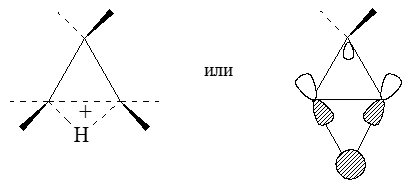
Рисунок 7.
В этом и других подобных случаях образуются мостиковые трехцентровые двухэлектронные связи, аналогичные связям в неклассических карбокатионах, таких как $C_2H_{5^+}$, возникающих при протонированиях, в данном случае этилена.
Малекулы бицикло[3.1.0]гексилтозилата вступают в реакции сольволиза гораздо легче, чем простой циклогексилтозилат. Исследование с радиоизотопной меткой показал, что образующиеся катионы имеют симметрию группы $C_{3^v}$. Это значит, что каждому метиновому атому углерода формально соответствует $1/3$ положительных зарядов карбокатионов, и между не соседствующими метиновыми группами формально имеются связи порядка $1/3$. Другими словами, образуется связывающая орбиталь $\chi$3:
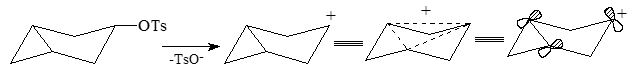
Рисунок 8.












