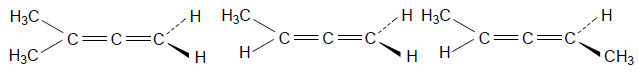Основные типы хиральности. Центральная хиральность
К основным типам хиральности относятся:
- центральная хиральность;
- аксиальная хиральность;
- планарная хиральность;
- спиральная хиральность.
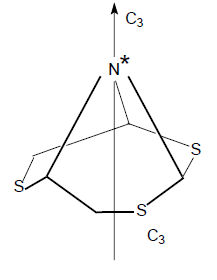
Хиральные центры могут быть образованы атомами углерода, кремния, четырехковалентного азота и фосфора, олова, в окисях третичных аминов и фосфинов и в четвертичных аммониевых солях.
Центральный атом в этих соединениях, как и асимметрический атом углерода, имеет тетраэдрическую конфигурацию. Хиральные центры, образованные атомами трехвалентного азота, мышьяка, фосфора, серы, сурьмы, четвертым заместителем в соединениях которых является неподеленная электронная пара, имеют пирамидальную конфигурацию.
Так как в большинстве соединений азота наблюдается инверсия свободной электронной пары, они не будут хиральными.
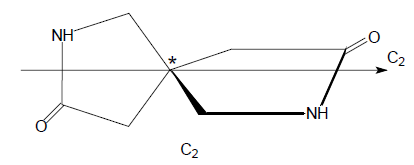
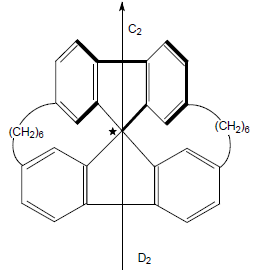
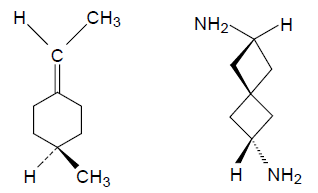
Частным случаем хирального центра является асимметрический центр. Молекулы симметрии $C_n$ или $D_n$ также, как и асимметрические молекулы могут иметь хиральный центр (помечен звездочкой):
Хиральный центр может находиться внутри молекулы и не быть привязанным к какому-то определенному атому.
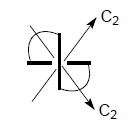
Аксиальная хиральность
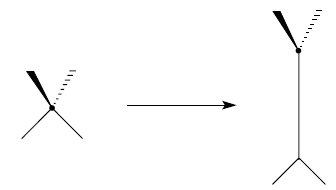
Молекулы имеющие хиральную ось обладают аксиальной хиральностью. Если хиральный центр мысленно растянуть, получится хиральная ось:
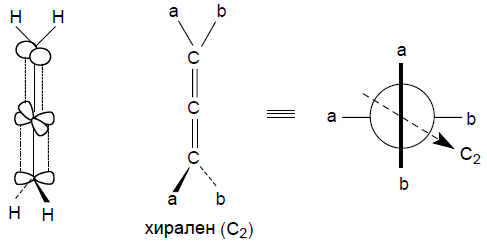
Аллены и дифенилы имеют хиральную ось. В алленах две взаимноперпендикулярные р-орбитали центрального атома углерода $sp$-типа перекрываются с $p$-орбиталью соседнего атома карбона. Оставшиеся связи концевых атомов углерода находятся в перпендикулярных плоскостях.
Пропадиен (аллен) ахирален, но несимметрично замещенные аллены $abC=C=Cab$ хиральны:
Ахирален Ахирален Хирален
Для 1,2,3-бутатриена четыре концевые группы располагаются в одной плоскости, что справедливо для соединений с нечетным числом кумулированных связей:

Молекула 1,2,3-бутатриена является ахиральной, для нее характерна цис-транс-изомерия.
Хиральность возможна при любом четном числе кумулированных связей.
Симметрично замещенный аллен будет обладать аксиальной хиральностью, если одну или две двойные связи заменить на циклическую систему:
Дифенилы в $o$-положениях содержат объемистые группы, поэтому свободное вращение вокруг центральной связи $C-C$ ограничено из-за стерических препятствий. В результате два бензольных кольца находятся в разных плоскостях. Пространственная изомерия, возникшая в результате отсутствия вращения вокруг простой связи называется атропоизомерией. Атропоизомерия – причина появления оптической активности:

Планарная хиральность
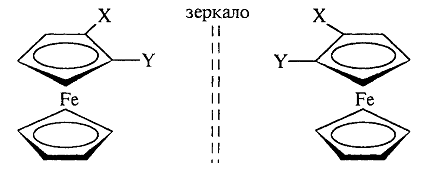
Когда определяющим структурным элементом в симметрии является плоскость, говорят о планарной хиральности. В плоскости можно выделить «верх» и «низ», а также стороны - «правую» и «левую».
Планарную хиральность имеют производные ферроцена, ареновые комплексы хромтрикарбонила

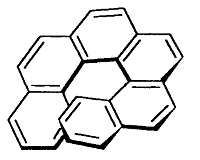
Спиральная хиларность
При спиральной форме молекулы наблюдается спиральная хиральность. Возможно наличие энантиомерных спиралей, возникновение которых обусловленно тем, в какую сторону – правую или левую - закручена спираль.
В молекуле гексагелицена $C_{26}H_{16}$ одна ее часть расположена над другой вследствие пространственных препятствий. Спираль молекулы имеет неполный поворот, при этом сохраняется и правая и левая ориентация.