Общие замечания
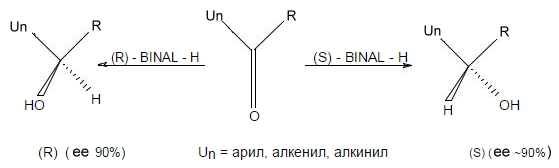
Одним из самых распространенных способов проведения асимметрического синтеза является получение хиральных спиртов путем присоединения к карбонильной группе. При этом результат синтеза зависит от пространственного строения соответствующего карбонильного соединения (рис. 1).

Рисунок 1. Пути осуществления ассиметрического синтеза. Автор24 - интернет-биржа студенческих работ
Асимметрическое восстановление карбонильной группы
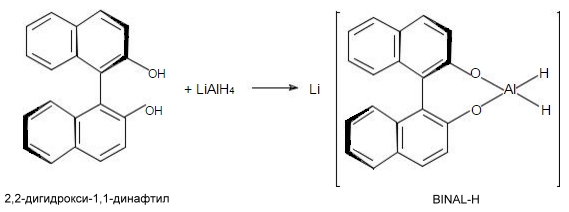
Как упоминалось выше, для асимметрического синтеза с энантиотопными карбонильными соединениями используются хиральные реагенты. Таковыми являются, например, гидриды алюминия или бора типа:
Рисунок 2.
Стереоселективность реакции с участием хирального реагента обеспечивается электронными взаимодействиями, сводящимися к отталкиванию заполненных электронных оболочек сближенных в пространстве групп.
Рисунок 3.

Рисунок 4. Циклическое переходное состояние. Автор24 - интернет-биржа студенческих работ
При этом реакция осуществляется через циклическое переходное состояние (рис. 4), в котором литий координируется к атому кислорода карбонильной группы, тем самым способствуя переходу гидридного атома водорода к углеродному атому.
В качестве хиральных реагентов также используются комплексные дейтериды алюминия $LiAlD(OR^*)_2$, пинанил-BBN.C (рис. 5), дигидропиридиновые соединения.

Рисунок 5. Пинанил-BBN.C. Автор24 - интернет-биржа студенческих работ
Особое значение имеют пространственные эффекты в ходе взаимодействия карбонильного соединения с хиральным реагентом. В общем случае стереоселективность реакции возрастает с увеличением размеров реагента.
Асимметрическое алкилирование карбонильной группы
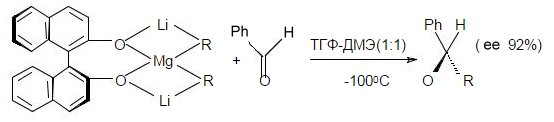
Для асимметрического аликилирования карбонильной группы также используются соединения таких металлов, как литий, магний, цинк, алюминий. Например:
Рисунок 6.
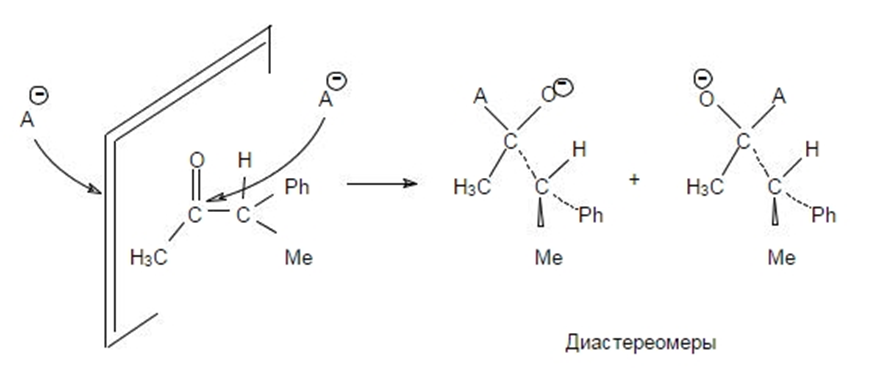
В случае диастереотопных альдегидов и кетонов асимметрический синтез называется, соответственно, диастереоселективным. Выход целевого продукта оценивается с помощью правил Крама и Прелога.
Правило Крама действует в случае, когда центр асимметрии в исходном кетоне непосредственно связан с карбонильной группой. В получающемся спирте, таким образом, будет уже два хиральных центра: существовавший в исходном карбонильном соединении и образовавшийся из карбонильной группы. Согласно правилу Крама, реагент будет «подходить» к молекуле преимущественно с той стороны, которая пространственно более свободна:
Рисунок 7.
Очевидно, что диастереоселективность реакции будет увеличиваться с увеличением размеров металлорганического реагента.
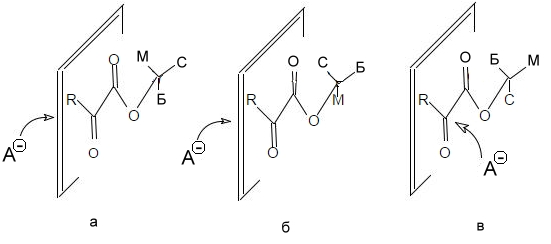
Правило Прелога звучит следующим образом: конфигурация центра асимметрии определяется направлением подхода атакующего агента, который, в свою очередь, атакует рассматриваемую молекулу со стороны наименьшего (по объему) из радикалов, не лежащих в плоскости молекулы. Данное правило используется, в частности, для предсказания стереоселективности взаимодействия реактивов Гриньяра к эфирам $\alpha$-оксокарбоновых кислот. Пусть имеется смесь трех конформеров эфира $\alpha$-оксокарбоновой кислоты (рис. 8а,б,в). Конформеры а и б атакуются реагентом слева, а конформер в – справа. Поскольку конформеры переходят один в другой с равной вероятностью, считаем, что их количество в смеси одинаково. Таким образом, атака слева будет происходить в два раза чаще, чем справа:
Рисунок 8.
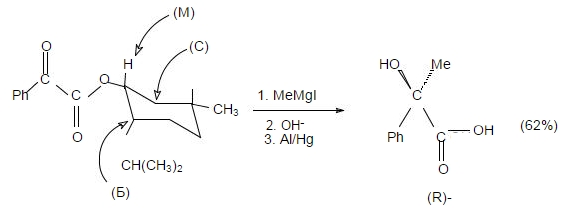
Правило Прелога подтверждается, например, следующей реакцией:
Рисунок 9.