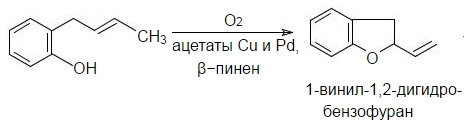
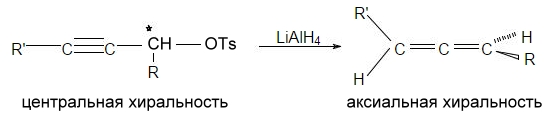Присоединение к двойным связям $C=C$
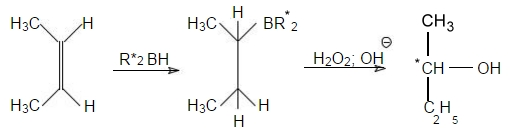
На реакциях присоединения к двойным связям основаны, в частности, асимметрические синтезы. Ярким примером является гидроборирование алкенов путем присоединения хиральных боранов. В ходе последующего окисления продуктов данной реакции получаются соответствующие спирты с почти 100%-ной оптической чистотой:
Рисунок 1.
$R^*$ = пинанил-3
Рисунок 2.
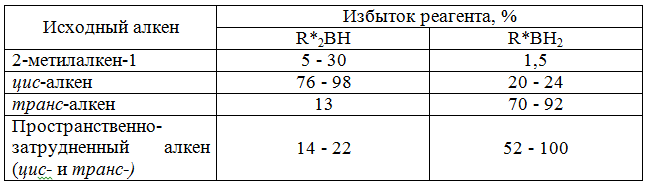
В данной реакции к двойной связи присоединяется ди-3-пинанилборан $(R^*2BH)$, однако вместо него можно использовать моно-3-пинанилборан $(R^*BH_2)$. С помощью этих реагентов в настоящее время синтезируются многие оптически активные спирты (табл.1).
Рисунок 3. Условия синтеза оптически активных спиртов. Автор24 - интернет-биржа студенческих работ
По данным табл.1 моно-3-пинанилборан является более подходящим реагентом для транс-алкенов и пространственно-затрудненных алкенов. В остальных случаях подходит ди-3-пинанилборан.
Асимметрический синтез аминокислот
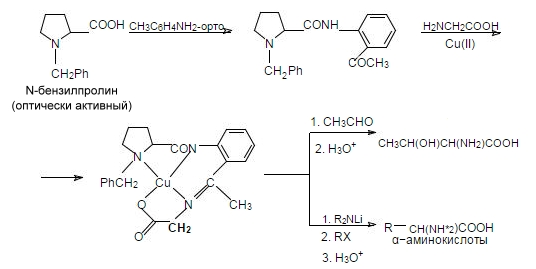
Оптически активные $\alpha$-аминокислоты эффективно синтезируются с использованием медьорганических комплексных соединений. Энантиомерные избытки в данном случае составляют 97 – 100%. Данный метод был предложен Ю.Н. Белоконем в 1982 г.:
Рисунок 4.
В данной реакции оптически активный $N$-бензилпролин взаимодействуя с орто-аминоацетофеноном превращается в соответствующий амид. Полученный продукт конденсируется с аминоуксусной кислотой (глицином) в присутствии солей двухвалентой мели с образованием комплексного соединения, в котором метиленовая группа (выделена полужирным шрифтом) характеризуется наличием подвижного атома водорода. В результате альдольной конденсации (верхняя стрелка) данного комплекса получается α-амино-$\beta$-гидроксикислота, а при алкилировании (нижняя стрелка) – соответствующие α-аминокислоты, обладающие высокой оптической чистотой.
Синтезы в хиральных средах
В случае, когда оба реагента ахиральны. но один из них обладает прохиральностью, в оптически активных средах происходят асимметрические реакции энантиоселективного типа. В качестве примера можно привести действие магнийорганических соединений на кетоны в присутствии эфиров винной кислоты:
Рисунок 5.
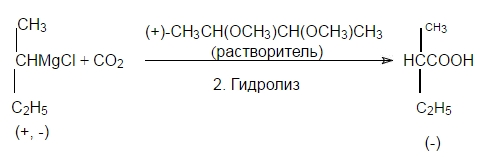
Если же один из реагентов хирален, но вступает в реакцию в виде рацемата, то в оптически активной среде скорость взаимодействия компонентов рацемической смеси будет различной. В результате образуется оптически активный продукт:
Рисунок 6.
В данной реакции в качестве оптически активного растворителя используется (+)2,3-диметоксибутан. Под действием пространственных эффектов этот растворитель образует с одной из энантиомерных форм рацемической смеси более прочные сольваты, чем с другой. Получающиеся сольваты по отношению друг к другу являются диастереомерами и поэтому скорость их взаимодействия с углекислым газом различна.
В дополнение стоит отметить, что асимметрический синтез можно реализовать и в хиральных жидких кристаллах. Однако, оптическая частота конечного продукта будет не такой высокой.
Абсолютный асимметрический синтез
Абсолютным асимметрическим синтезом называется синтез в условиях отсутствия асимметрических реагентов, в том числе в отсутствие асимметрических катализаторов. Данный вид синтеза отличается от рассмотренного ранее тем, что в нем в качестве фактора асимметрии выступает физическое воздействие на реакционную систему, например поляризованный свет (т.н. фотохимический асимметрический синтез).
В качестве примера можно привести возникновение оптической активности рацемического диметиламида α-азидопропионовой кислоты под действием циркулярнополяризованного света:
Рисунок 7.
В зависимости от коэффициентов поглощения циркулярнополяризованного света компонентами рацемической смеси будет образовываться энантиомерный избыток право- или левовращающего изомера.
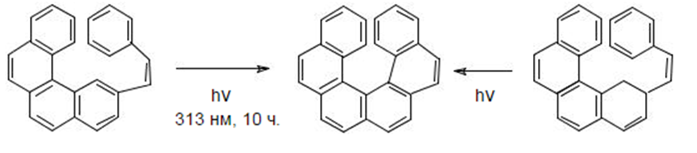
Также известны примеры абсолютного асимметрического синтеза в твердой фазе под действием энантиоморфной кристаллической решетки:
Рисунок 8.
Асимметрическая индукция аксиальной и планарной хиральности
В данном случае хиральный центр образует хиральную ось или хиральную плоскость в молекуле продукта реакции.
Примером образования хиральной оси может служить превращение пропаргильных соединений с хиральным центром в аксиально хиральные аллены:
Рисунок 9.
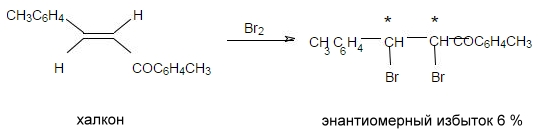
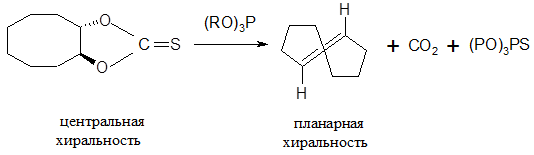
Примером образования планарной хиральности служит синтез оптически активного транс-циклооктена:
Рисунок 10.