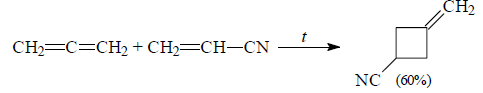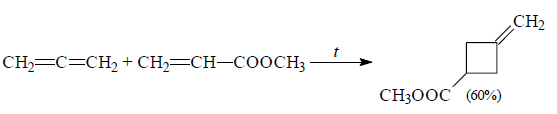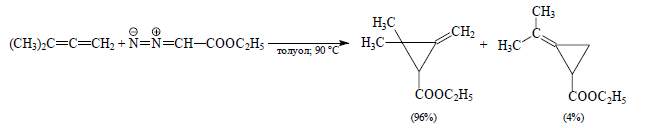Общая характеристика
Реакции циклоприсоединения к кумулированным диенам подразделяют на процессы $[π^2 + π^2]$, $[π^2 + π^4]$, $[π^2 + ω^0]$-циклоприсоединения.
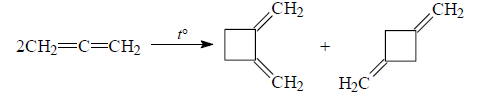
Процессы $[π^2 + π^2]$-циклоприсоединения – это реакции термической циклодимеризации алленов.
Например: Димеризация аллена пропадиена ведет к образованию смеси 1,2- и 1,3-диметиленциклобутана. Соотношение продуктов реакции зависит от температуры: при 110 ºС транс-изомера будет 100%, а при 170 ºС на долю транс-изомера приходится 65%, а цис-изомера – 35%:
Рисунок 1.
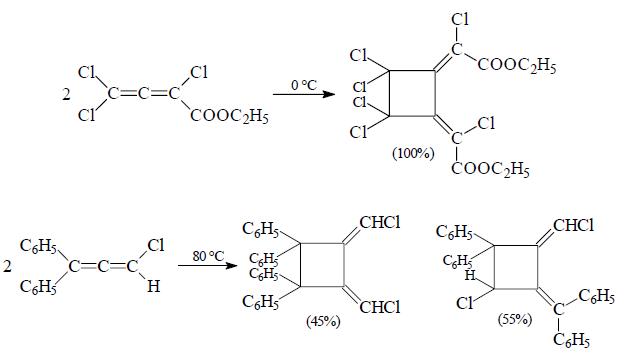
Димеризация замещенных диенов приведет к образованию двух изомерных производных.
Например: Образование производных 1,2-диметилциклобутана
Рисунок 2.
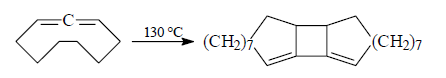
Подобным образом будет проходить димеризация циклических 1,2-диенов:
Рисунок 3.
Региоселективность получения двух 1,2-диметиленциклобутанов будет определяться как отношение продуктов димеризации по типу «голова к голове» и «голова к хвосту» и зависеть от природы заместителей в аллене.
- атомы галогена и алкильные заместители способствуют димеризации по типу «голова к голове»;
- арильные группы способствуют присоединениюдвух молекул аллена по типу «голова к хвосту».
При наличии электроноакцепторных заместителей продуктами реакции являются метиленциклобутаны:
Рисунок 4.
Рисунок 5.
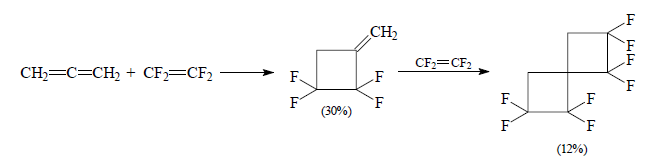
В случае взаимодействия аллена с перфторэтиленом образуется метиленциклобутан и продукт $[π^2+ π^2]$-циклоприсоединения:
Рисунок 6.
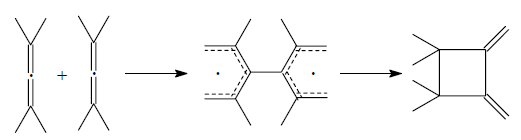
Для реакций $[π^2 + π^2]$-циклоприсоединения, реакции димеризации с участием кумулированных диенов предложен механизм, предусматривающий образование бирадикальных интермедиатов:
Рисунок 7.
Реакции $[π^4 +π^2]$-циклоприсоединения Дильса-Альдера
Реакции Дильса-Альдера относятся к реакциям $[4π +2π]$-циклоприсоединения, где аллены выполняют роль диенофила.
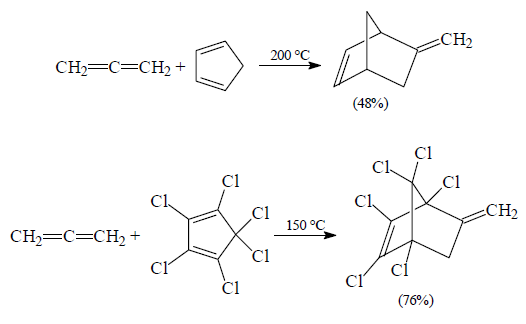
Например: При взаимодействии кумулированного диена с гексахлорциклопентадиеном образуются метиленнорборнены:
Рисунок 8.
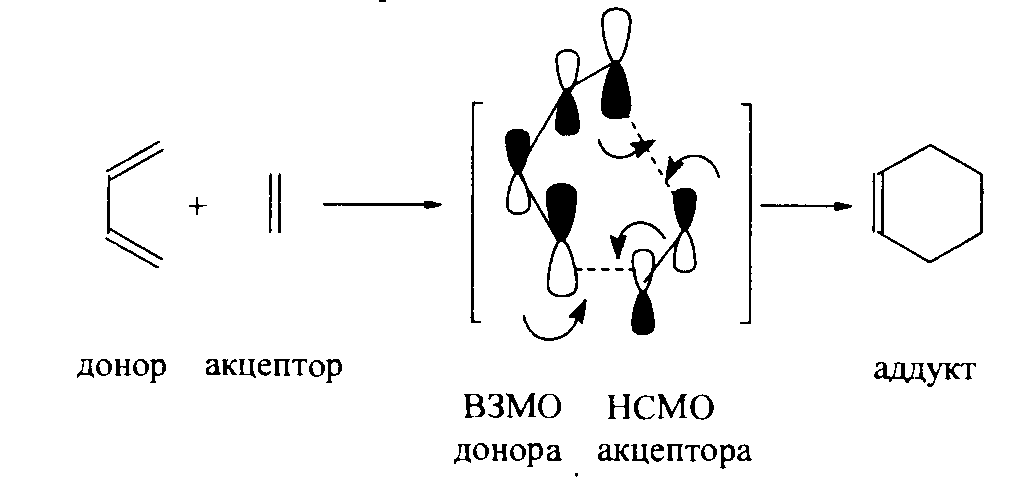
Реакция циклоприсоединения в пределах теории молекулярных орбиталей рассматривается как взаимодействие донора и акцептора, а также подчиняется орбитальному контролю.
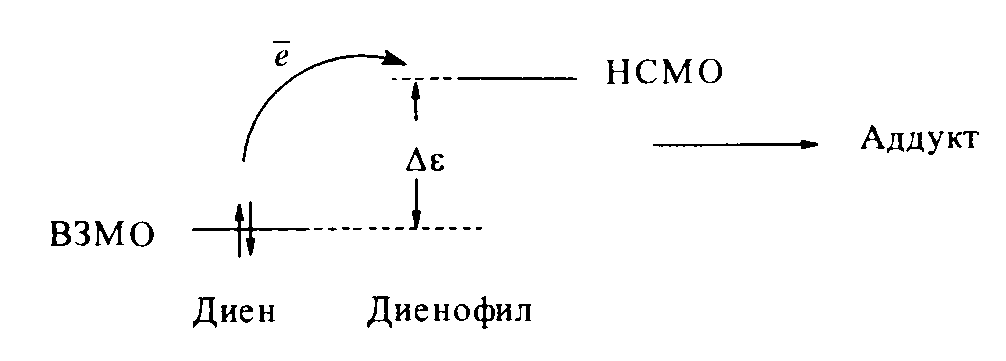
Так, в реакциях Дильса-Альдера диен выполняет роль донора, а диенофил – акцептора электронов. Следовательно, орбитальному контролю в переходном состоянии данных реакций обеспечивается связывающее взаимодействие концевых π-атомных орбиталей двух реагентов – ВЗМО диена и НСМО диенофила:
Рисунок 9.
Реакции Дильса-Альдера ускоряются электронно-донорными заместителями в диене (они повышают уровень энергии ВЗМО диена) и электроноакцепторными заместителями в диенофиле (снижают уровень энергии НСМО диенофила).
Эти эффекты сближают энергии граничных реагентов, что в свою очередь снижает энергию переходного состояния и повышает скорость реакции.
Рисунок 10.
Взаимодействие с карбенами
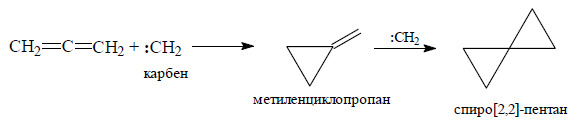
Присоединение карбенов является согласованным процессом циклоприсоединения. Взаимодействие синглетной формы карбенов с двойной связью аллена является хелетропным процессом, при котором образуются две $σ$-связи с одним углеродным атомом карбена.
В результате взаимодействия карбенов с алленами образуются метиленциклопропаны, способные присоединить по двойной связи еще одну частицу $:CH_2$ или $:CX_2$ с образованием спиро[2,2]-пентанов.
Рисунок 11.
При взаимодействии тетраалкилалленов с карбеном основным продуктом реакции являются производные метиленциклопропана. Карбен присоединяется первоначально по наиболее замещенной двойной связи диена:
Рисунок 12.
Также по наиболее замещенной двойной связи происходит присоединение дихлор- и дибромкарбена.
Наиболее эффективное присоединение дигалокарбенов происходит в двухфазной системе (в качестве катализаторов межфазного переноса используется водный раствор гидроксида натрия в присутствии четвертичных солей аммония). В таких условиях можно присоединить к молекулу аллена один или два дигалогенкарбена.