Уравнение Гаммета описывает линейную зависимость свободной энергии, относительной скорости реакции и константы равновесия реакций с участием многих производных бензола и бензойной кислоты с мета- и пара-заместителями. Это уравнение было разработано и опубликовано Луи Гамметом в $1937$ году на основании анализа проведенных им экспериментов с рядом веществ.
Основная идея заключается в том, что для любых двух реакций с двумя ароматическими разными реагирующими веществами, отличающиеся друг от друга только заместителем, изменение свободной энергии активации пропорционально изменению свободной энергии Гиббса. Эта закономерность не вытекает из элементарной термохимии или химической кинетики и была введена Гамметом экспериментально.
Основное уравнение уравнение Гаммета
Основное уравнение уравнение Гаммета описывает влияние мета- или пара-заместителя $X$ на реактивность функциональной группы $Y$ в производных бензола $(XC_6H_4Y).$
Основное уравнение имеет вид:

где $k$ и $K$ - константы скорости и равновесия, соответственно, для данной реакции с $XC_6H_4Y$; $k_0$ и $K_0$ касаются реакции $C_6H_5Y$, то есть при $X = H;\sigma$ - характеристическая константа заместителя; $\rho$ - характеристическая константа для реакции данного реакционного центра $Υ$.
Это уравнение часто встречается в форме, где $logk_0$ и $logK_0$ выделяются как отдельный член справа уравнения в виде:
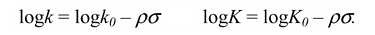
В этом случае отрезок, который отсекает на оси ординат линия регрессии $logk_0$ или $logK_0$ от $\sigma$ соответствует $X = H$.
Расширенное уравнение Гаммета
Расширенное или обобщенное уравнение Гаммета используется для любого много-параметрического расширения уравнения Гаммета. Также так иногда называют специальные двупараметрические уравнения, в которых коррелируются определенные значения величины ρ с константами заместителя $X$, а не со значениями, отнесенными к величине при $X = H.$ Отрезок, отсекаемый на оси, в этом случае соответствует значению $\rho$ при $X = H$:
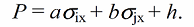
В такие уравнения могут быть введены дополнительные члены, отражающие другие эффекты, например стерические.
Характеристическая константа $\rho$
Характеристическая константа $\rho$ определяется мерой чувствительности к воздействию заместителя на константу скорости или равновесия для данной реакции в определенной реакционной серии подобных субстратов. Впервые она была определена Гамметом для эффекта заместителей в мета- и пара-положениях к заместителю в бензольном кольце, который является реакционным центром, по эмпирическим уравнениям, имещим форму:
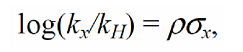
где $\sigma_x$- константа, величина которой зависит от природы заместителя $X$ и его положения в молекуле реактанта.
В общем случае (и не только для ароматических серий) константы $\rho$ используются для определения чувствительности реакционных серий ряда различных органических соединений к любым эффектам заместителей. В данном случае пользуются модифицированным набором $\sigma$-констант в рамках эмпирической $\sigma \rho$ -корреляции.
Реакции с положительной константой $\rho$ ускоряются заместителями с положительными $\sigma$-константами. Поскольку знаки констант $\sigma$ были определены так, что заместители с положительными $\sigma$ увеличивают кислотность бензойной кислоты, такие заместители характеризуются способностью притягивать электроны из ароматического кольца. Из этого следует, что реакции с положительным значением $\rho$ имеют переходное состояние (или продукт реакции) такой, что разница энергии между этим состоянием и реактантом уменьшается при снижении электронной плотности на реактивном центре субстрата.
$\sigma$-Константа
$\sigma$-Константа это константа заместителя (константа Гаммета), характеризующая электронный эффект мета- и пара-заместителей по сравнению с водородом в уравнении Гаммета. $\sigma$-Константа определяется логарифмом отношения констант равновесия соответствующей замещенной бензойной кислоты к незамещенной, измеренных в воде при $298$ К.
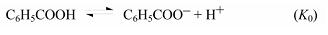
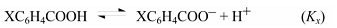
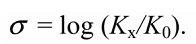
Электроноакцепторные заместители характеризуются положительными значениями $\sigma$, а электронодонорные - отрицательными. Большое положительное значение $\sigma$ предполагает высокое электроноакцепторное действие вследствие индуктивного и резонансного эффекта по отношению к водороду. Большое отрицательное значение σ предполагает высокое электронодонорное действие.
Константа $\sigma$ в уравнении Гаммета для различных реакций имеют разную величину для одного и того же заместителя.












