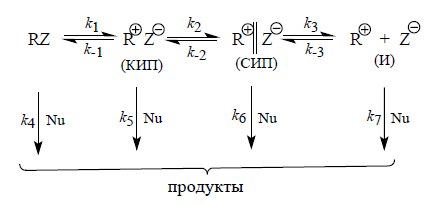
Общая схема реакций нуклеофильного замещения
Существует множество механизмов нуклеофильного мономолекулярного замещения:
где КИП –контактная ионная пара; СИП – сольватно – разделенная ионная пара; И- свободные ионы.
В реакциях $SN1$(КИП), $SN1$(СИП), $SN1$(И) медленной стадией являются стадии 1,2,3 соответственно. В случаях, когда медленной стадией являются стадии 4,5,6 или 7, то такой процесс относится к бимолекулярным реакциям $SN2$(КИП), $SN2$(СИП), $SN2$(И). Однако это описание не является абсолютно точным.
Например: Если в реакции $SN1$ медленной стадией которой является образование контактно – ионной пары $k_5 > k_2$, то ее завершением будет быстрая нуклеофильная атака тесной ионной пары. Когда $k_2 > k_5$ тесная ионная пара способна диссоциировать дальше. При этом стадии 6 и 7 будут определять состав и строение продуктов.
- Классическим $SN2$-механизмом является механизм Ингольда – Хьюза (соответствует реакции $k_4$). Стереохимический эффект такой реакции – полная инверсия конфигурации.
- При классическом $SN1$-механизме происходит полная диссоциация, продукты реакции образуются на 7 стадии. Стереохимическим результатом может быть как полная инверсия, так и полная рацемизация.
Если реакция не идет дальше тесной ионной пары, то происходит инверсия (гидролиз пара-хлорбензгидрил-пара-нитробензоата в присутствии $NaN_3$).
Если реакция идет через полностью диссоциированные ионы, то она приводит к полной рацемизации. Если в реакции участвуют сольватно – разделенные ионные пары, то происходит частичная рацемизация.
Классические реакции мономолекулярного нуклеофильного замещения
В элементарной стадии, которая определяет скорость реакции участвует один из реагентов. Ионизация органического реагента $RX$ является медленной стадией. Взаимодействие положительного иона $R^+$ со вторым реагентом $Y$ является быстрой стадией.
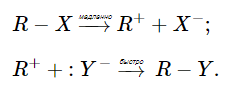
Для реакций, протекающих по $SN1$-механизму, в основном, $R$ является третичным алкилом, а реагент $Y$ – растворителем.
В зависимости от растворителя выделяют следующие реакции:
- сольволиз (растворитель вода);
- алкоголиз (растворитель спирт), продуктом реакции является простой эфир;
- ацидолиз (растворитель карбоновая кислота), продуктом реакции является сложный эфир.
Механизм реакции определен характером заместителя, реагента и растворителя.
При $SN1$-механизме скорость реакции зависит от сольватирующей способности растворителя. На скорость не оказывает влияние нуклеофильная активность реагента $Y$.
Сильно реакционноспособный карбокатион может неселективно реагировать со всеми нуклеофильными молекулами, находящимися в растворе (растворитель SOH и нуклеофильный реагент). Следовательно $SN1$-реакцию можно изобразить следующим образом:

Влияние растворителя на скорость $SN1$-замещения
Эффективной движущей силой в реакциях $SN1$-замещения является сольватация переходного состояния и образующихся ионов:
$S + R-X + S → S^{δ+}…R…X… S^{δ-} → S^+…R + X…S^-$
Чем больше растворитель проявляет способность содействовать ионизации электролитов, тем выше скорость нуклеофильного мономолекулярного замещения.
Способность растворителя содействовать процессу ионизации можно расположить в ряд:
$H_2O > C_2H_5OH > CH_3COCH_3 > C_6H_6$
Если в качестве растворителя используют водно – ацетоновые или водно – этанольные растворы, то скорость реакции будет расти с увеличением концентрации воды.
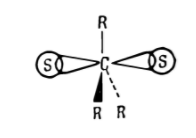
Сольватирующая способность растворителей предопределена образованием слабых химических связей между ионами и молекулами растворителя. В сольватированном карбокатионе две орбитали молекул растворителя $S$ связаны с центральным пятивалентным атомом углерода и перекрывают выпуклости свободной $p$-орбитали:
Кривые потенциальной энергии в мономолекулярной реакции нуклеофильного замещения
Механизм $SN1$ можно изобразить кривыми потенциальной энергии как функцию межатомного расстояния:
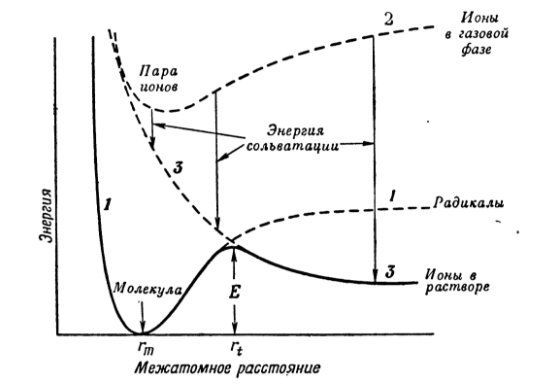
Кривая 1 показывает изменение энергии при диссоциации молекулы на радикалы $R•$ и $X•$. Кривая 2 определяет энергию несольватированных ионов $R^+$ и $X^-$. Кривая 3 показывает отталкивание между ионами $R^+$ и $X^-$ как функцию расстояния.
При сольватации ионов наблюдается большой выигрыш энергии. Рост энергии связи $R-X$ предопределен энергией сольватации ионов в переходном состоянии. Переходное состояние представлено точкой пересечения кривых 1 и 3, а соответствующая энергия $E$ является энергией активации.