Механизм реакции мономолекулярного замещения
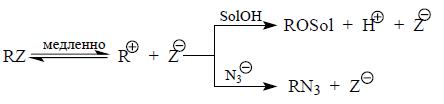
Механизм нуклеофильного замещения $SN_1$ включает две стадии:
- Гетеролитическое расщепление связи $C-Z$ в субстрате $RZ$ при котором образуются трехкоординированный карбокатион $R^+$ и анион в виде уходящей группы $Z^-$. Стадия медленная, определяет скорость всего процесса.
- Взаимодействие карбокатиона $R^+$ с нуклеофильным агентов $Nu$ или $Nu^-$ с образованием конечного продукта замещения. Не влияет на общую скорость.
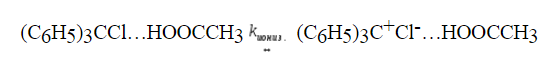
Скорость реакции v можно выразить как отношение
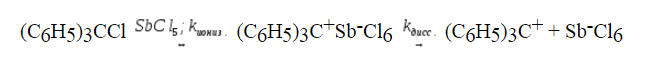
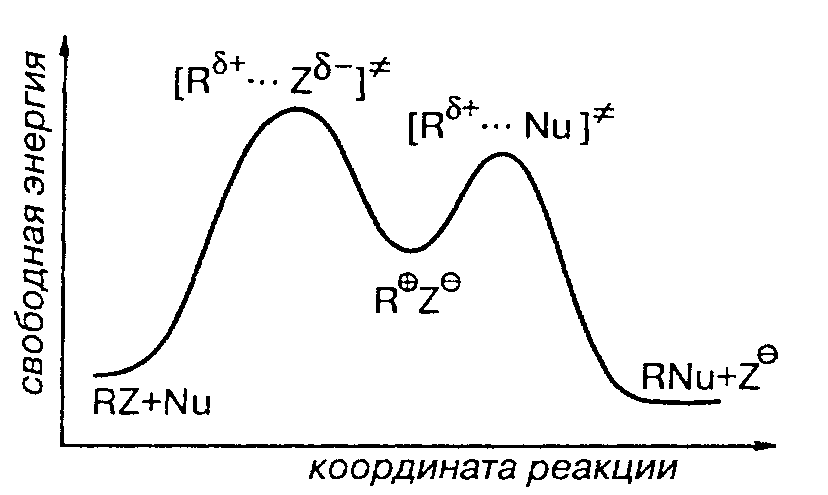
Первая стадия ионизации $RZ$ отображена на диаграмме идеализированного мономолекулярного нуклеофильного замещения:
Стадия ионизации $RZ$ характеризуется наибольшей энергией активации, чем для стадии рекомбинации $R^+$ и $Nu$. Вторая стадия предопределяет количественный состав продуктов $SN_1$-реакции.
При наличии в растворе нескольких разных нуклеофилов, то выход продуктов реакции с карбокатионом будет выражаться высотой второго барьера.
В идеале скорость $SN_1$-реакции не должна зависеть от природы нуклеофила. Однако, при наличии нескольких нуклеофилов, состав продуктов реакции будет определяться их относительной нуклеофильностью.
Ионизация $RZ^-$ процесс эндотермический и переходное состояние будет подобно карбокатиону $R^+$. Факторы, стабилизирующие карбокатион, стабилизируют и переходное состояние, приводящее к его образованию.
Реакции мономолекулярного нуклеофильного замещения обычно являются сольватическими. В них растворитель вызывает как ионизацию связи $C-Z$ в $RZ$, так и сам является нуклеофильным реагентом в реакции
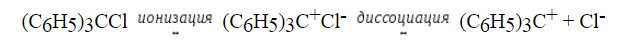
В этом случае концентрация растворителя в ходе реакции практически не меняется и имеет первый кинетический порядок независимо от механизма ($SN_1$ или $SN_2$).
Стабильность карбокатионов
Стабилизация карбокатионов происходит за счет:
- индуктивных эффектов заместителей;
- эффектов сопряжения и гиперконъюгации.
Стабильность алифатических карбокатионов повышается в ряду: первичный → вторичный → третичный.
$SN_1$-механизм возможен для вторичных и третичных алкилсульфонатов и алкилгалогенидов.
Например: Сольволиз трет-бутилбромида в 106 раз выше, чем у изо-пропилбромида в полярном и ионизирующем (муравьиная кислота) растворителе.
Аналогичную закономерность можно наблюдать у сульфонатов и циклоалкилгалогенидов.
Высокую стабильность эффект сопряжения определяет:
- триарилметильных $ArC^+$ карбокатионов;
- бензильных $ArC+H_2$ карбокатионов;
- бензгидрильных $Ar_2C+H$ карбокатионов;
- аллильных карбокатионов.
Мономолекулярный механизм замещения наблюдается у $Ar_3CX$, $Ar_2CHX$, сульфонатов, аллилгалогенидов.
При гидролизе трифенилхлорметана $(C_6H_5)_3CCl$ и бензгидрилхлорида $(C_6H_5)_2CHCl$ в 80% водном растворе ацетона, процесс с первым соединением протекает в 106 раз быстрее, чем во втором. В то же время $(C_6H_5)_2CHCl$ гидролизуется в тысячу раз быстрее, чем 1-хлор-1фенилэтан $C_6H_5CH(Cl)CH_3$.
Эффект общего иона и солевые эффекты
Скорость $SN_1$-реакций зависит от концентрации аниона уходящей группы $Z^-$. В начале реакции концентрация $Z^-$ мала. Однако, уже на начальном этапе кинетической кривой скорость реакции равна
$v=k_1 [RZ].$
От природы нуклеофила $Nu$, его концентрации скорость реакции не зависит.
Если при растворении малорастворимого электролита, активность одного иона, образовавшегося во время реакции, увеличивается, то активность другого уменьшается. Таким образом, их произведение остается постоянным.
Если же к раствору добавить хорошо растворимый электролит, имеющий такой же ион, что и малорастворимый электролит, то растворимость последнего уменьшится. Это явление называется эффектом общего иона.
Скорость гидролиза $(C_6H_5)_2CHBr$ и $(C_6H_5)_2CHCl$ при введении в раствор $LiCl$ и $LiBr$ соответственно, возрастает. При этом действует нормальный солевой эффект: увеличение ионной силы раствора стабилизирует полярное переходное состояние $SN_1$-реакции, поэтому реакция ускоряется.
Однако при введении солей, которые имеют общий ион с галогенидом, происходит замедление реакции $((C_6H_5)_2CHBr$ и $LiBr$; $(C_6H_5)_2CHCl$ и $LiCl).$ В этом случае действуют два эффекта: нормальный солевой эффект ускоряет реакцию замещения, эффект общего иона замедляет реакцию, смещая равновесие ионизации влево. Суммарно эффект общего поля будет преобладать.
Критерии диссоциативного SN1-механизма
- С ростом концентрации аниона $Z^-$ скорость реакции должна уменьшаться. Эта зависимость носит линейный характер. Эффект общего иона называется «внешним возвратом из диссоциированной формы».
-
Введение «нуклеофильной ловушки».
Например: Роль «нуклеофильной ловушки» выполняет азид-ион $N_3^-$ для карбокатиона $R^+$:
где $ROS_ol$ – протонный растворитель.
Азид-ион не должен влиять на скорость реакции, но должен оказывать влияние на соотношение продуктов реакции $RN_3$ и $ROS_ol$. Фактор конкуренции (селективности) в ходе реакции не должен меняться:
F_N=[RN_3 ]/[ROSol] .
-
Независимость величины фактора селективности от природы уходящей группы $Z^-$ в субстрате $RZ$. Для алициклических и алифатических соединений нуклеофильное замещение $SN_1$ конкурирует с мономолекулярным элиминированием $E_1$ протона с образованием алкена.
- Соотношение алкена и продуктов сольволиза по ходу реакции должно быть постоянным.
- Соотношение алкена и продуктов сольволиза не должно зависеть от природы уходящей группы.
Для диссоциативного механизма $SN_1$ все критерии должны выполняться одновременно. Но на практике обычно все пять критериев выполняются редко.
Например: При гидролизе трет-бутилбромида или трет-бутилхлорида соотношение изо-бутилена и трет-бутилового спирта будет зависеть от природы уходящей группы.
Фактор селективности зависит от природы уходящей группы гидролиза ($C_6H_5)_3CBr$, ($C_6H_5)_3CCl$, ($C_6H_5)_3CF$ в присутствии азид-иона.