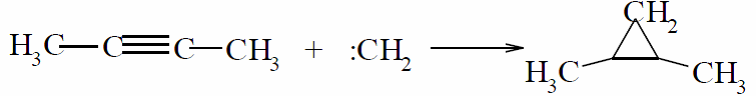Простой метод распознавания синглетных и триплетных частиц основан на известной реакции присоединения карбенов по месту двойной связи с образованием производных циклопропана. Например, если к цис-бутену-2 присоединяется синглетная частица, то синтезированный циклопропан является цис-изомером, поскольку перенос двух пар электронов должно происходить одновременно или в быстрой последовательности.
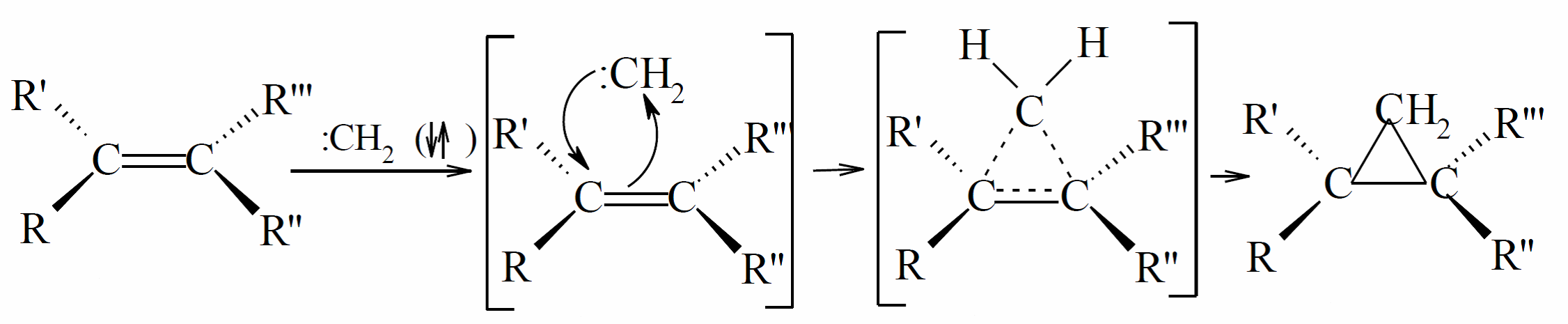
Взаимодействие с ненасыщенными соединениями, которые приводят к образованию циклопропана и продуктов их вторичных реакций, является самой распространенной и изученной реакцией карбенов, которая наиболее широко используется в синтезе. Согласно одному из постулатов Скелли присоединения синглетных карбенов по связи $С = С$ проходит строго цис-стереоспецифически, а присоединение триплетных частиц - нестереоспецифично. Для триплетного метилена $\sigma$-подход к этилену хоть и разрешен по симметрии, но на промежуточной стадии он не происходит, а образуется триплетный триметиленовий бирадикал. Барьер активации этой реакции ≈ 20кДж / моль, а тепловой эффект равен 209 кДж / моль. В то же время для синглетных карбенов σ-подход запрещен по симметрии, и на больших расстояниях ($r > 0,25$ нм) молекула карбена ориентируется своей вакантной $p$-орбиталью на один из атомов углерода кратной связи. Глубокое изучение механизма присоединения карбенов по кратным связям только начинается.
Механизм межмолекулярного присоединения карбенов
Механизм межмолекулярного присоединения карбенов к алкенам широко обсуждался в течение многих лет. С поразительной химической интуицией Скелл в 1956 г. предположил, что механизм и стереохимия реакции зависят от спинового состояния карбена:
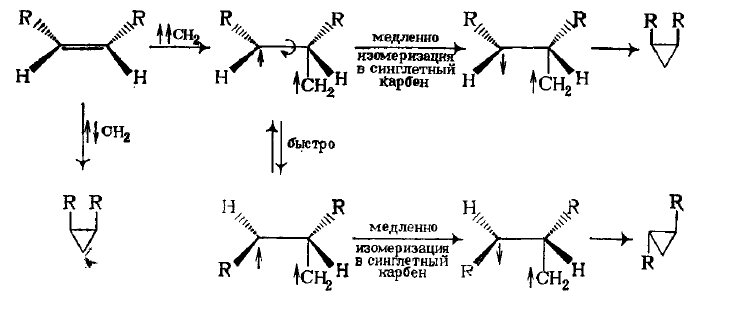
Итак, присоединения синглетного карбена по месту двойной связи представляет собой электрофильное синхронное цис-присоединения с сохранением конфигурации исходного олефина:
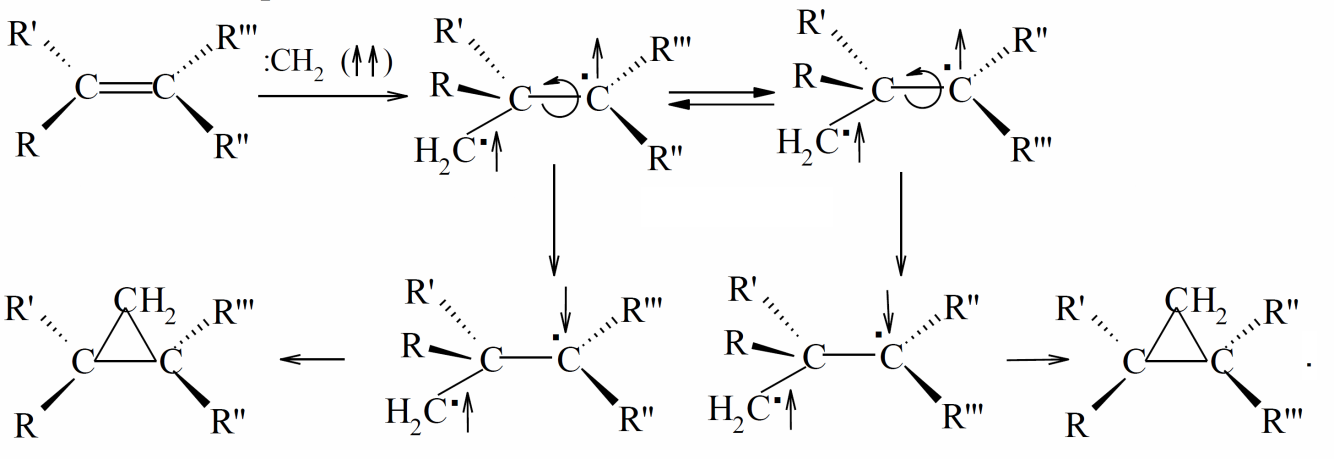
Во время атаки триплетной частицы новая ковалентная связь не может быть образованна двумя неспаренными электронами, поскольку в соответствии с правилом Гунда они имеют параллельные спины. Один из неспаренных электронов карбена может образовывать связь с $\pi$-электроном двойной связи, что имеет противоположный спин. В этом случае в молекуле остаются два неспаренных электрона с одинаковым спином, которые не могут образовывать связь сразу, а должны ждать процесса столкновения, в ходе которого один из электронов должен изменить свой спин на противоположный. За это время происходит свободное вращение фрагментов интермедиата вокруг $С-С$ связи, вследствие чего образуется смесь цис- и транс-1,2 диметилциклопропанов:
Высказанное выше предположение о том, что синглетный метилен в газовой фазе сначала превращается в триплетный, а затем вступает в реакцию, можно подтвердить получением как с цис-, так и с транс-бутена-2 смеси изомеров цис- и транс-диметилциклопропанов. Если фотолиз происходит в жидкой фазе, то синглетный («горячий») метилен успевает прореагировать, прежде чем станет триплетным («холодным»). Об этом свидетельствуют результаты стереоспецифичности присоединения.
Тройная связь реагирует подобно двойной, присоединяя метилен:
Применение присоединения карбенов и карбеноидов к алкенам
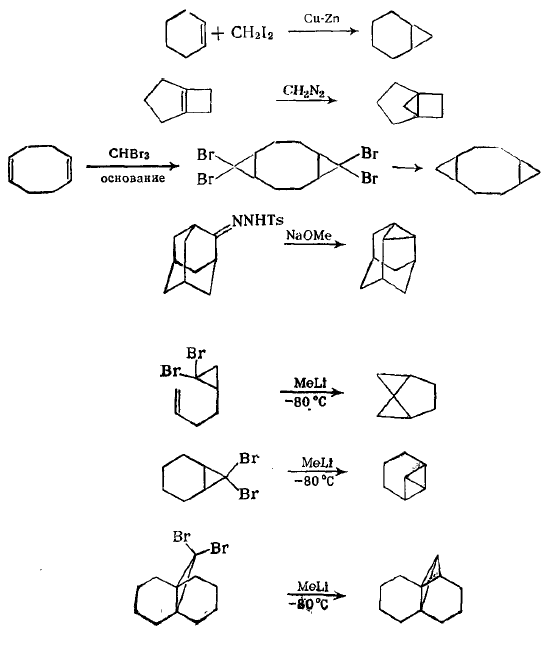
Присоединение карбенов и карбеноидов к алкенам является общим путем синтеза замещенных циклосоединений. Часто применяющимися реагентами является комбинация йодистого метилена и цинк-медной пары (реагент Симмонса-Смита). Свободный метилен не является интермедиатом в такой реакции; вероятно, он переносится на $С=С$-связь через металлорганический интермедиат. Имеется много путей генерации карбена и карбеноидных интермедиатов. Наиболее важными из них являются:
- фотолиз, термолиз или катализуемое ионами металлов разложение диазоалканов;
- фотолиз или термолиз солей сульфонилгидразонов; интермедиатами являются диазоалканы;
- фотолиз диазиринов;
- действие сильных оснований или металлорганических реагентов на алкилгалогениды;
- термолиз галогенртутных соединений.
При проведении этих реакций в присутствии олефина образуются циклопропаны. Примеры реакций карбенов и карбеноидных реагентов приведены ниже:
Кроме того. в последнее время пристальное внимание уделяют присоединению гетероциклических карбенов.
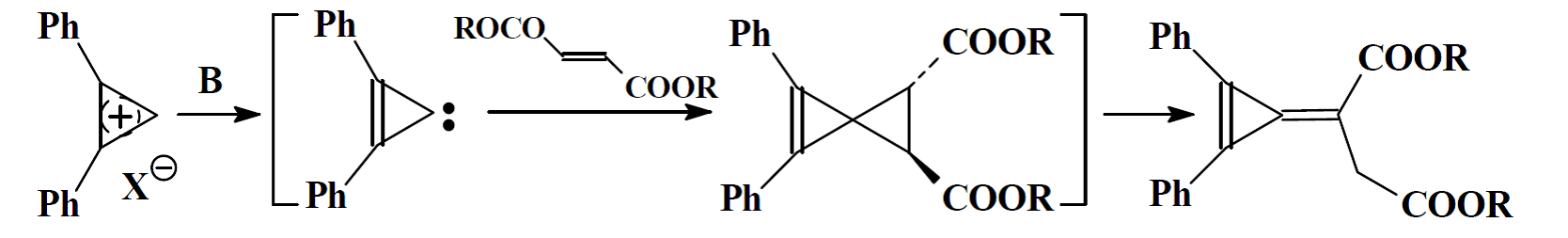
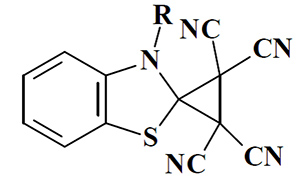
Нуклеофильные гетероароматические карбены, благодаря своей электронодонорной природе, не реагируют с такими ловушками электрофильных карбенов как циклогексен. Однако бензотиазол-2 илиден образует аддукты с субстратами, которые содержат электронодефицитные кратные связи:
Известно преобразования циклопропенилиденов с эфирами фумаровой кислоты в соответствующие производные циклопропенилиден янтарной кислоты:
При взаимодействии карбона с кратными связями образуются продукты присоединения, однако только в том случае, если электрофил достаточно сильный и способен конкурировать с карбеногеном, и, как правило, содержит электроноакцепторные заместители, иначе появляются также продукты самоконденсации - диммеры карбенов.
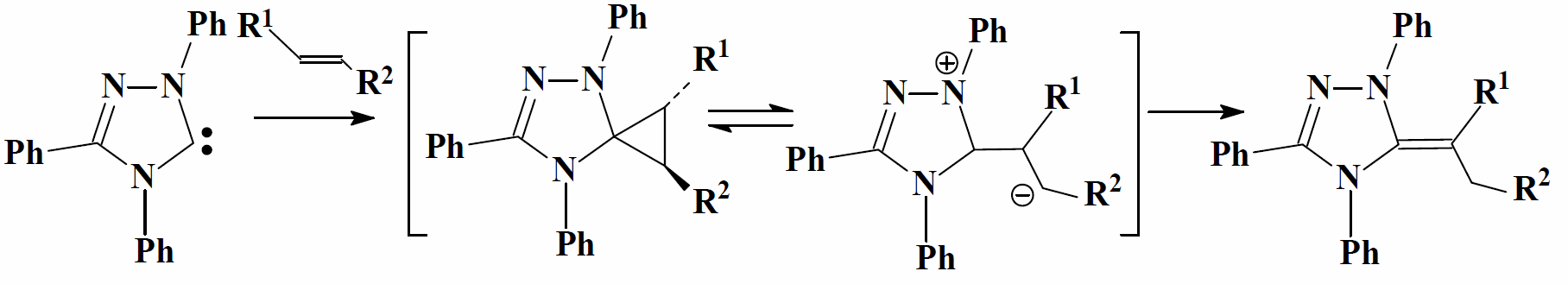
Получены несколько продуктов преобразования индивидуального 1,2,4-триазол-5-илиден с эфирами фумаровой и малеиновой кислот, акрилонитрилом, нитростиреном и малеимида ($N-Me$, $Bu$, $Ph$). В процессе сначала происходит образование гипотетического спироциклопропана, который дальше переходит в карбанионы. Затем осуществляется сдвиг иона водорода ($1,2-Н$) с образованием соответствующего азолинилиденсукцинимида:
Наличие в цепочке преобразований карбанионов подтверждается получением димерных продуктов присоединения, образующихся в результате нуклеофильной атаки карбанионов второй молекулой олефина.