
Общие положения
На конфигурацию алкильных карбанионов оказывает влияние нахождение неподеленной электронной пары на $s$-орбитали. Пирамидальная конфигурация обусловлена тем, что ее неподеленная электронная пара обладает более низкой энергией, когда находится на орбитали с большим $s$-характером.
Ядро атома находится в узловой зоне, $p$-орбиталь вблизи ядра отсутствует. В результате электроны, находящиеся на $p$-орбитали притягиваются к ядру хуже, чем электроны, расположенные на сферически симметричной $s$--орбитали.
Повышение $s$-характера будет вести к изменению форма орбитали, тем самым приближая ее к чистой $s$-орбитали:
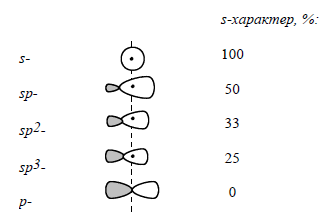
Рисунок 1.
При увеличении $s$-характера орбитали, которая несет отрицательный заряд, стабильность карбанионов возрастает:
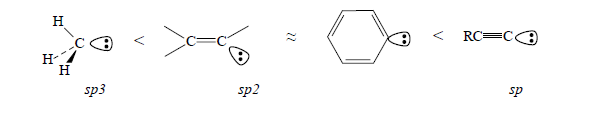
Рисунок 2.
Это отображается на кислотности рКа соответствующих $CH$-кислот.
Например:

Рисунок 3.
Возможно проявление экстремальных случаев углового напряжения.
Экстремальные случаи углового напряжения наблюдаются в соединениях кубана (а) ($s$-характера $CH$-связи равен $30-32\%$), бициклобутана (б) и трициклогексана (в) ($s$-характера $CH$-связи равен $40-41\%$) и подобных веществ. В кубане скорость обмена водорода будет выше, чем в бензоле, а в бициклобутане и трициклогексане -- выше, чем в кубане.
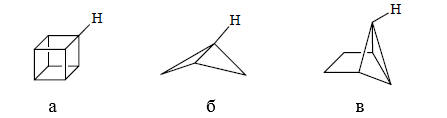
Рисунок 4.
Зависимость кислотности соединений от $s$-характера $C-H$-связи
Процентное содержание $s$-характера $C-H$-связи связано с угловым напряжением. Если у тетраэдрического атома углерода угол между связями уменьшен в результате включения этого атома в малый цикл, $s$-характер экзоциклической двойной связи $C-H$ увеличивается.
Следовательно, в соответствующем карбанионе возрастает $s$-характер несвязывающей орбитали, так как алкан и карбанион имеют одинаковые конфигурации. В результате кислотность увеличивается в ряду циклогексан -- циклопентан -- циклобутан -- циклопропан, что подтверждено экспериментальными данными по исследованию кинетической кислотности (при $\frac{k_H}{K_D}=6,5$) в системе циклогексиламин -- циклогексиламид цезия:
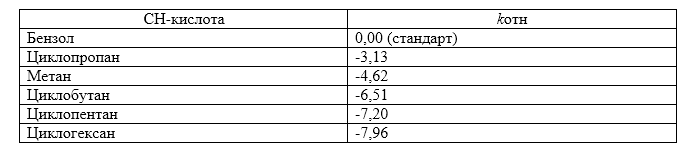
Рисунок 5.
Кинетическая кислотность повышается в ряду:
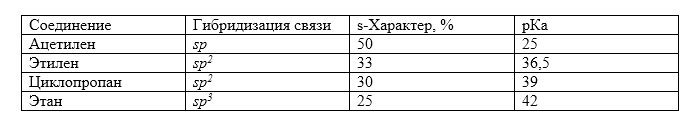
Рисунок 6.
Между степенью $s$-характера и значениями кислотности вещества существует линейная зависимость: чем больше $s$-характер $C-H$-связи, тем сильнее $CH$-кислота. Электроны $2s$-орбитали расположены к ядру ближе, чем электроны $2p$-орбитали. Поэтому устойчивость карбанионов будет тем больше, чем выше $s$-характер занимаемой орбитали.
На графике изображена зависимость значений $pka$ от степени $s$-характера $C-H$-связи. На оси ординат показана степень $s$-характера орбиталей атома углерода, которые участвуют в образовании $C-H$-связи, по оси абсцисс показана кислотность $pka$ соответствующей $CH$-кислоты:
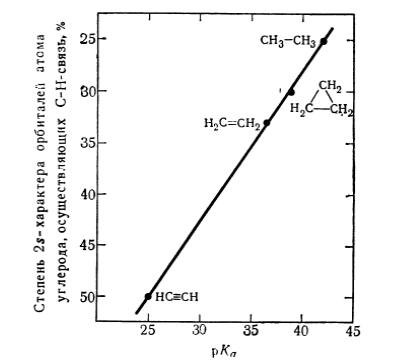
Рисунок 7.
Влияние скорости обмена водород-дейтерий на $s$-характер
В соединениях I, II и III атом водорода, помеченный кружком, вступает в реакции обмена водород -- дейтерий, которая катализируется основанием и в реакцию металлирования.
В трициклическом углеводороде IV степень $s$-характера для экзо-циклической орбитали у атомов $C_1$ и $C_2$ рассчитана из констант спин-спинового взаимодействия $^{13}C-H$ и составляет $40$ и $29\%$ соответственно. Значения $pka$ для атомов углерода приблизительно равно $32$ и $39$. Для $C_1$ в соединении III найдена величина $s$-характера связи, равная $44\%$ с $pka\approx 29$. Водород в данном соединении в обмене водород-дейтерий под воздействием трет-бутилата калия обменивается с трет-бутиловым спиртом в $104$ раз быстрее, чем в соединении IV.
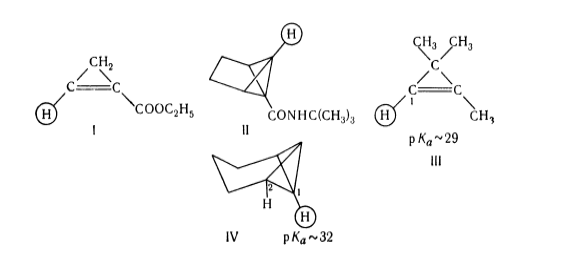
Рисунок 8.











