Теоретические основы переходного состояния
В ходе реакции могут образовываться интермедиаты (промежуточные соединения), которые оказывают влияние на механизм реакции.
Интермедиат может разлагаться со скоростью большей, чем $10^{13}c^{-1}$ (мономолекулярно) или со скоростью большей, чем $5\cdot 109л/моль\cdot с$ (бимолекулярно).
При более длительном существовании переходного состояния необходимо учитывать
- строение второго реагента;
- строение субстрата;
- особенности среды;
- присутствие катализатора и др.
На основании экспериментальных данных были сделаны выводы:
- В пределах погрешности зависимость удельной скорости реакции от обратной температуры изображается прямой линией.
- На скорость реакции оказывает влияние изменение концентрации и природы находящихся в растворе ионов в той же мере, что и на равновесие реакции между ионами с зарядами, равными зарядам реагентов.
- Влияние изменений в строении исходных веществ на удельную скорость может быть количественно соотнесено с влиянием подобных изменений на константы равновесия. Эти корреляции -- линейные зависимости свободных энергий показывают линейные соотношения, которые соответствуют как логарифмам удельных скоростей, так и логарифмам констант равновесий.
Во многих реакциях нет заметного прямого перехода от реагента к продукту реакции без промежуточного соединения. Однако, следуя принципу микроскопической обратимости, это соединение должно быть промежуточным и в обратной реакции.
В реакции превращения диэтилацеталя в диметилацеталь в присутствии катализатора кислоты в качестве интермедиата образуется метилэтилацеталь. На рис. 1 показано, что система, дошедшая до уровня $T_1$, который на $21$ ккал выше уровня стандартного потенциала диметилацеталя, должна возвратиться на последний в форме метилэтилацеталя, прежде, чем достигнет уровня $T_2$, который ниже $T_1$ на $1,2$ ккал.
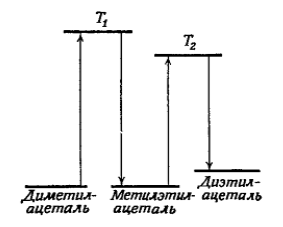
Рисунок 1. Изменение стандартного потенциала в ходе превращения диметилацеталя в диэтилацеталь
Оба переходных состояния являются сложными. Вначале образуются промежуточные соединения
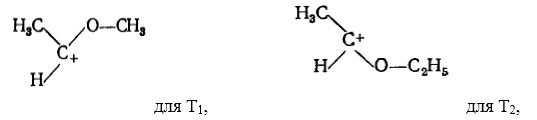
Рисунок 2.
а потом переходные вещества, предшествующие образованию $(A)$ или расходу $(B)$ метилэтильного соединения.
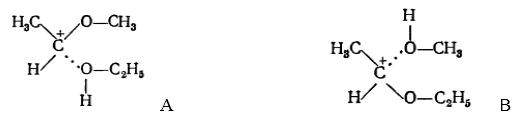
Рисунок 3.
Оба переходных состояния будут отличаться:
- удлиняющимися и укорачивающимися связями $C-O$;
- положением протона;
- распределением молекул растворителя.
Любое движение от $T_1$ к $T_2$ , осуществляемое без переходного состояния, сопровождается преодолением барьера, гораздо большего, чем $T_1$ или $T_2$. Заселенность промежуточного состояния $T_1$ меньше, чем промежуточного метилэтилацеталя. Движение даже через небольшой барьер между $T_1$ и $T_2$ происходило бы с меньшей частотой, чем прохождение от сильно заселенного промежуточного соединения через высокий барьер $T_2$.
Продвижение от реагентов к интермедиату
Скорость образования продукта $C$ из вещества $B$, которое находится в подвижном равновесии с веществом $A$:
где $k_2$- удельная скорость превращения $B$ в $C$;
$K_1$- константа равновесия взаимопревращения $A-B$.
При использовании теории переходного состояния получим
Для прямого образования $C$ из $A$ уравнение имело бы аналогичный вид.
Данные механизмы кинетически неотличимы. Влияние на скорость реакции строения (в том числе и изотопное замещение), температуры, давления предопределяется разностью между влиянием на стандартный потенциал переходного состояния и на сумму стандартных потенциалов реагентов.
Эти влияния не зависят от механизма образования интермедиата и поэтому не могут дать информацию об этом механизме.
Продвижение от интермедиата к продуктам реакции
В ходе реакции $1$-хлорпропана с сильным основанием образуется олефин. $1$-хлорпропан при комнатной температуре представляет собой смесь трех веществ $A, B, C$, присутствующих в сравнимых количествах и образующих подвижную равновесную смесь.
Эти вещества являются конформерами. Взаимоотношения между ними отличаются только с количественной стороны, энергетический барьер между коформерами равен $3-4$ ккал.
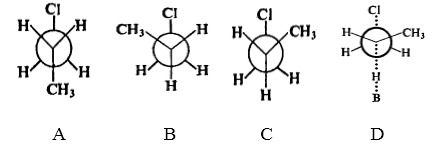
Рисунок 4.
Если строение цикла не позволит атомам водорода и хлора занимать положения, подобные положениям атома хлора в веществах $B$ и $C$, то образование олефина из циклического соединения будет затруднено.
Поэтому как в циклическом, так и в ациклическом соединениях, наилучшая ориентация в переходном состоянии соответствует соединению $D$ или его зеркальному изображению. Только в таком положении происходит понижение энергии переходного состояния при образовании олефиновой $\pi $-связи.
В результате структурного подобия переход из состояния $B$ в $D$ должно происходить чаще, чем из положения $A$ в $D$.
В случае обратимости процесса превращения хлорпроизводного в олефин, часть потенциальной кривой реакции продвижения от хлорпроизводного к интермедиату имела бы вид, подобный практически необратимой реакции. Происходило бы движение вперед и назад между хлорпроизводными и системами, едва не достигшими переходного состояния.
До тех пор, пока скорость взаимопереходов конформеров $A$, $B$ и $C$ будет велика по сравнению со скоростью образования хлорпроизводного, продуктом реакции будет равновесная смесь конформеров. В данном случае состав продуктов определяется термодинамическими факторами.
Если продуктами являются циклические соединения, не подверженные взаимным переходам, то из переходного состояния схожего с $D$ главным образом получается структура $B$.












