Применение главного уравнения термодинамики в кислотно - основных взаимодействиях
Мерой кислоты или основания являются константа кислотности $pKa(AH)$ или константа основности $pKa(BH^+)$. Со свободной энергией кислотно - основного равновесия они связаны соотношением:
где $\triangle G_{T^0}$ -- изменение стандартной свободной энергии при переходе от реагентов к продуктам при температуре $T$ для водных растворов.
При температуре $298 \ К \ 2,3RT = 1,36$ ккал/моль, поэтому
Свободная энергия кислотно -- основной реакции при заданной температуре, изменение стандартной энтальпии $(\triangle H^0)$ и стандартной энтропии $(\triangle S^0)$ характеризуются главным уравнением термодинамики:
Для химического применения наиболее удобны величины $(\triangle H^0)$ и $(\triangle S^0)$.
Чтобы узнать, будет ли протекать реакция в нужном направлении, необходимо определить $\triangle G$ для реакции «реагенты -- продукты» или «начальное состояние -- конечное состояние»:
$\triangle G = Gпродукты - Gреагенты.$
Если $\triangle G$ имеет отрицательное значение, то реакция протекает самостоятельно и смещается в сторону образовавшихся веществ. При положительном $\triangle G$ прямая реакция, в отличие от обратной, самопроизвольно протекать не может.
Энтальпия
Энтальпия (теплосодержание) соединения $(H)$. В случае протекания реакции говорят об изменении энтальпии $(\triangle H)$:
если $\triangle H
-
если $\triangle H > 0$, то реакция эндотермическая, энергия поглощается.
Значения энтропии могут служить характеристиками для энтальпии реакции:
-
Если изменение величины энтропии $\triangle S$ невелико для каждой отдельной реакции из серии реакций, и изменение свободной энергии приблизительно равно величине изменения энтальпии $\triangle G~\triangle H$, то изменение энтальпии характеризует скорость и направление реакции.
-
Если изменение энтальпии велико по абсолютной величине, но для каждой отдельной реакции из серии реакций $\triangle S$ одинаковы, то изменение энтальпии характеризует легкость протекания каждой из реакций.
-
Если $\triangle S~0$ или $\triangle S~ const$, то в качестве «движущей силы» реакции применяют степень эндотермичности или экзотермичности процесса.
Изменение энтальпии измеряется инструментально при помощи калориметра. Так же можно получить следующие данные:
-
теплоты образования соединений из элементов $\triangle H_{обр}$;
-
теплоты сгорания $\triangle H_{сгор.}$;
-
энергии диссоциации связей в молекулах $(D)$ и др.
Используя табличные значения теплоты образования соединений, теплоты сгорания и др., можно рассчитать энтальпии разных фазовых превращений и химических процессов.
Согласно закону Гесса, тепловой эффект процесса зависит только от начального и конечного состояния системы и не зависит от пути перехода его из одного состояния в другое.
Закон Гесса имеет свои следствия:
-
Тепловой эффект разложения соединения равен по абсолютной величине и противоположен по знаку тепловому эффекту его образования.
-
Для двух реакций, приводящих из разных начальных состояний к одинаковым конечным, разность тепловых эффектов данных реакций равна тепловому эффекту перехода одного начального состояния в другое.
$C_{(графит)} + O_2 = CO_2 + 393,77$ кДж
$C_{(алмаз)} + O_2 = CO_2 + 395,65$ кДж
Вычитая первое уравнение из второго, получаем
$C_{(графит)} - C_{(алмаз)} = 1,88$ кДж.
Таким образом, $1,88$ кДж представляет собой тепловой эффект перехода одного начального состояния в другое.
- Для двух реакций, приводящих из одинаковых начальных состояний к разным конечным, разность тепловых эффектов данных реакций равна тепловому эффекту перехода одного конечного состояния в другое.
$C + O_2 = CO_2 + 393,8$ кДж
$C + \frac{1}{2} O_2 = CO + 110,6$ кДж
Вычитая второе уравнение из первого, получаем
$\frac{1}{2} O_2 = CO_2 - CO + 283,2$ кДж или
$CO + \frac{1}{2} O_2 = CO_2 + 283,2$ кДж
Величина $283,2$ кДж является тепловым эффектом перехода из одного конечного состояния в другое (Рис. 1)
-
Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ.
\[\triangle Н={\Sigma \triangle Н}_{обр.кон}-{\Sigma \triangle Н}_{обр.исх}\] -
Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции.
\[\triangle Н={\Sigma \triangle Н}_{сгор.\ исх}-{\Sigma \triangle Н}_{сгор.кон}\]
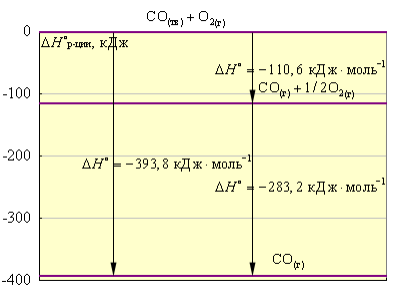
Рисунок 1. Диаграмма энтальпии взаимодействия углерода с кислородом
Энтропия
Возможность системы самостоятельно переходить из упорядоченного состояния к хаотичному характеризует энтропия $(S)$. Энтропия служит мерой беспорядка системы. Изменения энтропии обуславливают возможность осуществления эндотермических процессов. Это обусловлено способностью процессов протекать самостоятельно в изолированных системах, при этом энтропия будет увеличиваться.
При заданной температуре энтропия является величиной постоянной.
Энтропия зависит от:
-
агрегатного состояния вещества, она увеличивается при превращениях твердого вещества в жидкое и, особенно, в газообразное;
-
молекулярной массы однотипных соединений $(CH_4, C_2H_6, H^-C_4H_{10})$;
-
строения молекулы;
-
изотопного состава;
-
аллотропической формы соединения (алмаз, карбид, графит);
-
температуры
Изменение энтропии зависит от состояния системы в начале и конце химического процесса:
Энтропия любого элемента, кристалла, молекулы и т.д. в основном электронном состоянии может быть представлена суммой слагаемых:
$S = S_{пост} + S_{вращ} + S_{кол}$,
где $S_{пост}$ -- энтропия, характеризующая поступательное движение молекул;
$S_{вращ}$ -- энтропия, связанная с вращением всей молекулы как волчка и с внутренним вращением вокруг $\sigma $- связей в молекуле;
$S_{кол}$ -- энтропия, характеризующая колебания атомов в молекуле (деформационные колебания, растяжение и сжатие связей и др.).














