Количественное описание принципа ЖМКО
Для количественного описания жестких и мягких кислот и оснований используют значения абсолютной электроотрицательности и абсолютной жесткости молекул.
Абсолютную электроотрицательность молекулы ($\chi $) можно охарактеризовать по положению средней точки между уровнями нижней свободной молекулярной орбитали ($HCMO$) и верхней занятой молекулярной орбитали (ВЗМО).
Абсолютная жесткость ($G$) - это величина, характеризующая энергетические щели между граничными молекулярными орбиталями молекул.
Чем выше абсолютная электроотрицательность, тем электроотрицательней молекула; чем выше значение абсолютной жесткости, тем «жестче» молекула.
При взаимодействии кислоты с основанием осуществляется формирование донорно -- акцепторного комплекса. Сила кислотно -- основного взаимодействия (прочность комплекса) определяется степенью переноса заряда от более электроотрицательной молекулы к менее электроотрицательной.
Степень переноса заряда $\triangle N$ имеет размерность долей электрона и связана с абсолютной электроотрицательностью и абсолютной жесткостью молекулы выражением:
где $A$ -- кислота, $B$ -- основание, $A$ и $B$ имеют одинаковую жесткость.
Чем больше разность электроотрицательностей между молекулами кислоты и основания, тем больше величина $\Delta N$. Чем больше жесткость взаимодействующих молекул кислоты и основания, тем меньше степень переноса заряда.
Разность электроотрицательностей является термодинамической движущей силой переноса заряда от основания к кислоте. Величину сопротивления переносу заряда определяет сумма абсолютных жесткостей молекул $A$ и $B$, т.е. связана с их поляризуемостью.
Образование аддукта между кислотой и основанием зависит от факторов:
- орбитального взаимодействия (взаимодействия граничных орбиталей);
- электростатического взаимодействия, которое значительно усиливается, если реагенты имеют противоположные заряды;
- пространственных препятствий;
- сольватации (если реакция протекает в растворе).
Взаимодействие граничных орбиталей
В реакции между основанием (донор электронов) и кислотой (акцептор электронов) протекают парные взаимодействия между всеми орбиталями кислоты и основания.
Главный вклад в общую энергию возмущения вносит связь между граничными орбиталями основания и кислоты: высшей занятой молекулярной орбиталью (ВЗМО) донора и нижней свободной молекулярной орбиталью ($HCMO$) акцептора. При качественном рассмотрении кислотно -- основного взаимодействия достаточно изучить взаимные возмущения ВЗМО донора и $HCMO$ акцептора, особенно если энергия электростатического взаимодействия, при сравнении двух пар, для каждой пары кислота -- основание будет одинакова.
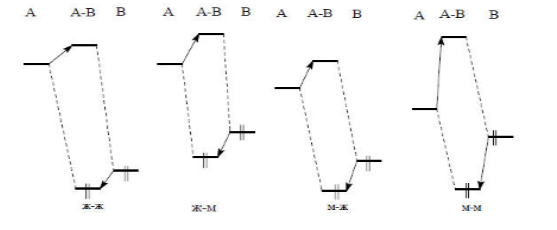
Рисунок 1. Возможные случаи взаимодействия граничных орбиталей при кислотно-основной нейтрализации ($HCMO$ кислоты $A$, ВЗМО основания $B$)
На рис.1 представлены возможные варианты взаимодействия граничных орбиталей в зависимости от взаимного расположения по энергии $HCMO$ кислоты и ВЗМО основания.
Взаимодействия граничных орбиталей не зависят от общего заряда, поэтому их показатели важны как при рассмотрении заряженных, так и незаряженных оснований.
Варианты взаимодействия граничных орбиталей:
-
Наибольшая стабилизация комплекса $AB$, при взаимодействии граничных орбиталей, следует для основания с относительно высокой энергией ВЗМО и для кислоты с относительно низкой энергией $HCMO$ (взаимодействие "мягкий-мягкий").
Значения энергии $HCMO$ и ВЗМО близки, т.е. энергия возмущения имеет большую величину. К кислотам с низкой энергией $HCMO$ относятся ионы тяжелых металлов с пустой s-орбиталью ($Ag^+$, $Cu^+$, $Hg^{2+}$) или нейтральные молекулы ($I_2$, $Br_2$, тетрацианоэтилен $(CN)_2C=C(CN)_2)$, а к основаниям с высокой энергией ВЗМО относятся: $CN^-$, $RS^-$, $R_3P$, $CO$ и т.д.
-
При взаимодействии кислот и оснований по типу «жесткий -- жесткий», энергетическое различие между ВЗМО и $HCMO$ очень большое. Поэтому возмущение при взаимодействии этих орбиталей будет совсем слабым. Достаточную стабилизацию комплекса АВ орбитальные связи обеспечить не могут. Данный комплекс может удерживаться только за счет сил электростатического притяжения.
Электростатические взаимодействия
При взаимодействии по типу «мягкий -- мягкий» происходит перенос заряда с ВЗМО основания на $HCMO$ кислоты. При взаимодействии между основанием и кислотой проявляется орбитальный контроль. Аддукт стабилизирует кулоновское взаимодействие за счет электростатических сил дальнего действия. В реакции проявляется зарядовый контроль при условии стабильности аддукта (из-за кулоновского взаимодействия).
Когда абсолютные жесткости молекул, вступающих во взаимодействие достаточно большие, проявляется зарядовый контроль для связи по типу «жесткий -- жесткий» (Рис. 1).
Согласно теории ЖМКО, жесткие кислоты реагируют с жесткими основаниями, а мягкие кислоты -- с мягкими основаниями. Это можно объяснить, исходя из степени взаимодействия в молекуле ВЗМО и $HCMO$ кислоты или основания:
-
жесткое основание имеет электронную пару, трудно поляризуемую, на низколежащей ВЗМО;
-
плохая поляризуемость ведет к тому, что электронная пара создает сильное электростатическое поле и прочно удерживается на ВЗМО;
-
таким же образом, в кислоте, при условии, что первая пустая орбиталь находится высоко, электроны на заполненных орбиталях плохо поляризуемы, в результате чего плотность пустой орбитали большая;
-
жесткая кислота и жесткое основание характеризуются сильным электростатическим полем и низкой поляризуемостью;
-
при тесном взаимодействии обоих жестких реагентов происходит сильная стабилизация;
-
при вовлечении в процесс мягкого реагента, диффузная природа его электронной оболочки приводит к уменьшению электростатического притяжения к противоиону.
Сольватация
Сольватация - это кулоновское взаимодействие между ионами, молекулами растворенного вещества и растворителя.
Малые ионы обладают жесткостью благодаря сольватации протонными растворителями. Протонные растворители имеют плотную «положительную» сольватную оболочку (атомы водорода воды ориентированы к иону), которая способна понижать ВЗМО малых анионов. Повышать энергию НСМО малых катионов будет «отрицательная» сольватная оболочка (атомы кислорода молекулы воды ориентированы к иону).
В результате, жесткость малых ионов будет «приобретенной». Частично малые ионы получают жесткость в начале взаимодействия кислоты и основания при прямом взаимодействии с партнером. В данном случае электростатическое поле данного партнера будет оказывать стабилизирующее влияние, аналогично влиянию протонных растворителей.
Например: Катион лития $Li^+$ в водном растворе можно сделать мягкой кислотой, если ввести его во внутреннюю полость молекулы краун-эфира или криптанда. Имея низкую $HCMO$, ион $Li^+$ будет вести себя так, как будто он изолирован и по размерам больше, чем на самом деле.












