${{\mathbf \sigma }}^{{\mathbf -}}$-константы
Область применения уравнения
можно повысить путем введения двух значений $\sigma $ для заместителей, способных к прямому резонансу.
Впервые этот прием был применен на примере $n-$ нитрогруппы. Ее $\sigma $-константа, равная $0,778$, вычислена по константе кислотности $n-$ нитробензойной кислоты. Данную константу можно применять с достаточной точностью ко многим реакциям, но она совершенно не подходит для реакций анилинов и фенолов.
Для описания влияния $n-$ нитрогруппы в реакциях анилинов и фенолов используют значительно большую константу, равную $1,27$.
В $1953$ году Джаффе предложил систему двойственных значений констант для $-T$-заместителей в $n-$ положении и обозначил эти константы $\sigma $*. В настоящее время для таких констант принято обозначение ${\sigma }^-$.
В таблице приведены ${\sigma }^-_р-,\ {\sigma }^-_а-$константы для некоторых заместителей. Константы ${\sigma }^-_р$ были получены по константам ионизации замещенных фенолов в воде. Константы ${\sigma }^-_а$ рассчитали по константам замещенных ионов анилиния.
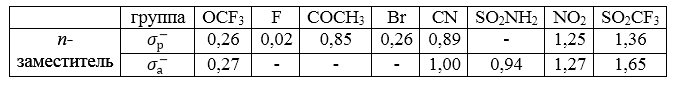
Рисунок 1.
${\mathbf \ }{{\mathbf \sigma }}^{{\mathbf +}}$-константы
Окамото и Браун для $+T$-заместителей в $n-$ положении предложили набор ${\sigma }^+$-констант, основанный на реакции сольволиза кумилхлоридов в $96\%$-ом водном ацетоне.
$+T$-заместители должны стабилизировать переходное состояние реакции благодаря прямому резонансу при котором из соединения

Рисунок 2.
можно получить
Эта зависимость охватывает только м-заместители, с хорошей точностью линейна, с наклоном $-4,54$. Точка, соответствующая $n-$ нитрогруппе, будет ложиться на ту же прямую, но $n-$ заместители типа $+T$ начнут проявлять значительные отклонения.
Замена $lg\left(\frac{k}{k_0}\right)$ для этих заместителей в уравнение
разрешает вычислить ${\sigma }^+$-константы.
Значения$\ {\sigma }^+$-констант для некоторых заместителей

Рисунок 3.
Существует много реакций, для которых можно ожидать прямого резонансного взаимодействия между $+T$-заместителем и реакционным центром, для которых величины $lgk$ линейно зависят от ${\sigma }^+$.
Для реакций замещения в бензольном ядре важно учитывать статистический фактор, а также коррелировать величины $lg\left(\frac{6k}{k_0}\right)$ для $n-$заместителей и $lg\left(\frac{6k}{{2k}0}\right)$ для м-заместителей с ${\sigma }^+$-константами.
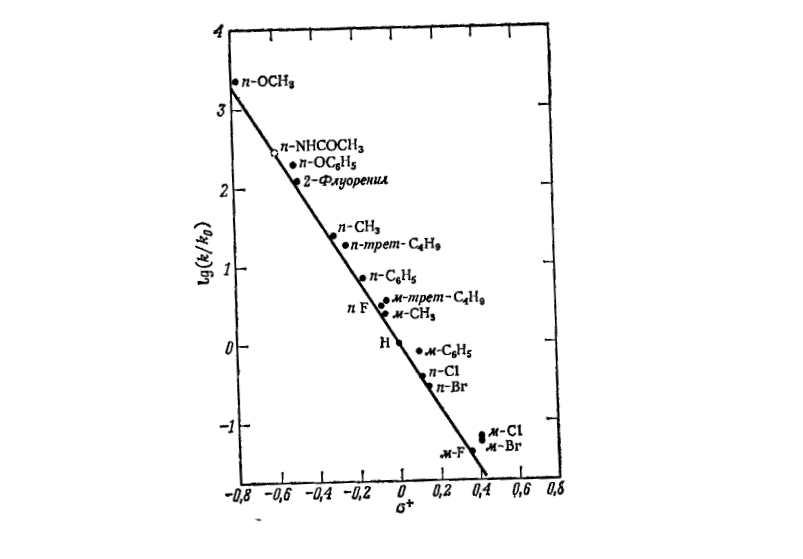
На рис.4 изображена линейная зависимость $lgk$-${\sigma }^+$ для реакции меркурирования производных бензола ацетатом ртути в уксусной кислоте.
 скоростей меркурирования замещенных бензолов с ${\sigma }^+$-константами">
скоростей меркурирования замещенных бензолов с ${\sigma }^+$-константами">
Рисунок 4. Корреляция удельных скоростей меркурирования замещенных бензолов с ${\sigma }^+$-константами
Схожие корреляции получены в реакциях галогенирования, нитрования, алкилирования.
Недостаточность двух ${\mathbf \sigma }$ констант
Применение двойного набора значений $\sigma $ полезно для:
-
систематизации и предсказания влияния заместителей;
-
выяснения природы переходного состояния.
Если в какой-либо реакции $lgk$ коррелирует с константами ${\sigma }^+$ лучше, чем с ${\sigma }^-$, то это указывает на сильное взаимодействие $+T$-заместителя с реакционным центром.
Существует мнение, что две группы констант заместителей показывают реальное деление реакций на два разных класса. Однако работы Андерсена и Бордуэля показали, что константа $\overline{\sigma }$ $n-$нитрогруппы для реакции ионизации тиофенолов, равна $1,00$ и занимает промежуточное положение между константами $\sigma \ и\ {\sigma }^-$.
Позже Веркаде, Ван Беккум и Вепстер доказали, что для значения $\overline{\sigma }$ $n-$нитрогруппы равномерно распределены в интервале от $0,6$ до $1,4$ и у них нет стремления группироваться вокруг величин $0,78$ или $1,27$. Для $n-$ метоксигруппы существует практически равномерное распределение в интервале от $-0,8$ до $0$.
Закономерности прямого резонансного взаимодействия
Линейная зависимость свободных энергий, несмотря на наличие заместителей, способных к сильному резонансному взаимодействию, может проявляться для реакций не схожих между собой.
На рис.4 одна реакция является сольволизом в боковой цепи, а другая показывает электрофильное ароматическое замещение.
В качестве критерия прямого резонансного взаимодействия рационально использовать величину
Тогда для заместителя $X$, способного к прямому резонансу, в первой реакции
а для второй реакции
где ${\rho }_1$ и ${\rho }_2$ найдены по влиянию заместителей, которые в резонансное взаимодействие не вступают.
Чтобы на графике $lgk_{1-}$ $lgk_2$ точка для заместителя $X$ находилась на прямой с наклоном $\rho $1/$\rho $2 нужно, чтобы
что возможно при одинаковой интенсивности прямого резонансного взаимодействия в обеих реакциях, то есть ${\sigma }^r_{х1}={\sigma }^r_{х2}$.











