Самоионизация воды
Вода, даже после многократной перегонки, сохраняет способность проводить электрический ток. Это способность воды обусловлена ее самоионизацией.
$2H_2O ↔ H_3O^+ + OH^-$
Термодинамическая константа равновесия имеет вид:
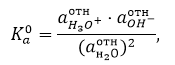
Рисунок 1.
где $а_X^{отн}=\frac{a_X^{равн}}{a_X^0}$ -- относительная активность частицы $X$ в равновесной системе;
$aX^{равн}$ - абсолютная активность частицы $X$ в равновесной системе;
${a_x}^0$ - абсолютная активность $X$ в термодинамическом состоянии системы.
Относительная активность воды при равновесии практически равна единице, так как степень протекания реакции очень мала (если за стандарное состояние брать теоретически неионизированную воду.
Коэффициенты активности ионов $OH^-$ и $H_3O^+$ будут близки к единице в читсой воде. Равновесие реакции сильно сдвинуто влево. Относительные активности $OH^-$ и $H_3O^+$ практически равны их молярным концентрациям. Откуда
${K_a}^0 \sim K_{авто} = [H_3O^+][H^-]$
где $[H_3O^+] и [OH^-]$ - молярные концентрации;
$K_{авто}$ - константа автопрополиза воды, равная $1,00\cdot 10^{-14} \ моль^2/л^2$ при $25^\circ \ C.$
В чистой воде концентрации $[H_3O^+] и [OH^-]$ будут равны, поэтому
$[H_3O^+]=[OH^- ]=\sqrt{10^{-14}}=10^{-7}$ при $25^\circ \ C.$
Для удобства расчетов концентрацию указывают в виде отрицательного логарифма, обозначаемого как $pH$:
$pH= -lg [H_3O^+]$
Показатели $pH$ для чистой воды равны $7$, в кислых растворах $pH 7$.
Диссоциация кислоты и константа кислотности
Для кислоты $AH$ диссоциацию можно выразить уравнением:
$AH + H_2O ↔ A^- + H_3O^+$
В состоянии равновесия относительная плотность воды при переходе от одной кислоты к другой изменяется незначительно, а при бесконечном разбавлении приближается к нулю. Поэтому используется термодинамическая константа кислотности $K_a^0$ ($AH$).
Отношение коэффициентов активности одинаково для всех кислот и равно единице, в случае, если процессы протекают в разбавленных растворах.
Тогда в разбавленном водном растворе в качестве меры силы кислоты используют константу кислотности $Ka (AH$), которую можно определить по формуле:
$Ka (AH)=\frac{[H_3O^+][A^-]}{[AH]}$
В формуле отображена молярная концентрация частиц при фиксированной температуре $(25^\circ \ C)$ в состоянии равновесия.
Чем выше константа кислотности, тем выше степень диссоциации, тем сильнее кислота. Для расчетов и характеристики кислотности используют отрицательный логарифм константы кислотности $pKa$.
$pKa (AH)= -lgKa (AH)$
Чем больше значение у константы кислотности, тем слабее кислота.
Величина константы кислотности равна тому значению $pH$ раствора, при котором кислота будет ионизирована наполовину:
$pKa (AH) = pH - lg \frac{[A^-]}{[AH]}$
Величина, характеризующая кислотность молекул воды в водном растворе равна:
$Ka=\frac{[H_3O^+][OH^-]}{[H_2O]}=\frac{Ka_{авто}}{[H_2O]}=\frac{10^{-14}}{55,5}$
Таким образом, при температуре $25^\circ C$, $pKa (H_2O) = 15,7$. Данная величина характеризует кислотность молекул воды в растворе.
Для гидроксониевого иона $pKa (H_3O^+) = pK_{авто} - pKa = 14-15,7 = -1,7.$
Величины $pKa$ являются табличными данными. Однако, для кислот с $pKa 0$ данные таблиц будут неточными.
Определить константы кислотности в воде путем прямого измерения концентраций $A^-$ и $AH$ можно только тогда, когда кислотная диссоциация происходит хоть в какой то степени, даже еле заметной.
Если кислота очень слаба, что практически не диссоциирует, то нельзя точно измерить концентрацию $A^-$. Если же, наоборот, кислота настолько сильна, что диссоциирует почти полностью, то невозможно измерить концентрацию $AH$. В таком случае будут использоваться косвенные методы определения кислотности.
Константа ионизации основания
Для выражения константы диссоциации основания в воде, воспользуемся уравнением:
$B + H_2O ↔ BH^+ + OH^-$
Константа основности равна:
$Kb=\frac{[BH^+][OH^-]}{[B]}$
В последнее время при расчетах константами основности практически не пользуются, так как по константе кислотности сопряженной кислоты можно получить всю необходимую информацию об основании $BH^+.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac{[H_3O^+][B]}{[BH^+]}$
Константа кислотности кислоты будет являться мерой силы:
- $AH$ или $BH^+$ как доноров протона;
- $A^-$ или $B$ как акцепторов протона;
- сильной кислоте $AH$ или $BH^+$ соответствует слабое сопряженное основание $A^-$ или $B$, и тогда величина $pKa$ мала или отрицательна;
- сильному основанию $A^-$ или $B$ соответствует слабая кислота $AH$ или $BH^+$ и константа кислотности будет положительна
Непосредственно измерить силу кислот или оснований можно только в узком интервале $pKa (BH^+).$ За пределами интервала основность будет определяться косвенными методами. Значения $pka (BH^+)$ вне интервала от $-2$ до $17$ будут неточными.
Корреляция между строением и силой кислот
Относительную силу кислот можно предсказать, основываясь на природе центрального атома и строении молекулы кислоты.
Сила бескислородной кислоты $HX$ и $H_2X$ (где $X$ -- галоген) тем выше, чем менее прочная связь $X-H$, то есть , чем больше радиус атома $X$.
В рядах $HF - HCl - HBr - HI$ и $H_2S - H_2Se - H_2Te$ сила кислот увеличивается.
Для кислородсодержащих кислот сила кислот тем выше, чем больше величина m в соединении состава $Э(OH)nOm$.











