Влияние заместителя на диссоциацию замещенных бензойных кислот
Диссоциация соединений группы мета- и пара-замещенных бензойных кислот зависит от расположения и природы заместителя $X$. Пусть данная реакция проходит в воде при температуре $25^\circ C$:
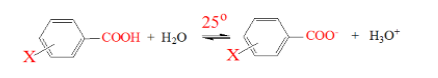
Рисунок 1.
Допустим, что мерой свойства заместителя (обозначим это свойство $\sigma $) является его влияние на кислотность. Реакционным центром в бензойной кислоте выступает карбоксильная группа.
Пусть $\sigma $ -- это величина, равная разности кислотности незамещенной и замещенной бензойных кислот:
$\sigma_x = pKa(C_6H_5COOH)-pKa(XC_6H_4COOH)$
или
$\sigma_х = lgKa(C_6H_5COOH)-lgKa(XC_6H_4COOH)$
-
Если $\sigma >0$, то наблюдается увеличение кислотности вещества при введении заместителя $X$. Кислотность будет увеличиваться с ростом возможности заместителя принимать отрицательный заряд от карбоксилатного аниона, падает $pKa$, увеличивается $Ka$. Заместители проявляют электроакцепторные свойства.
Если $\sigma
Константы заместителей, определенные при диссоциации замещенных бензойных кислот при $25^circ C$ имеют следующие значения
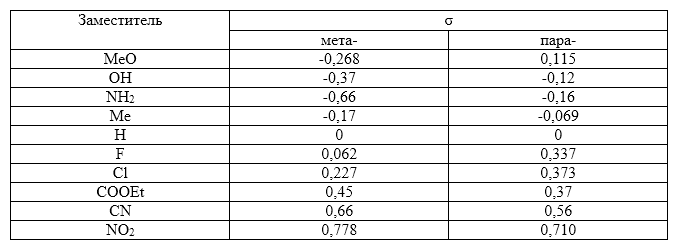
Рисунок 2.
Для замещенных бензойных кислот справедлива линейная корреляция (Рис.2).
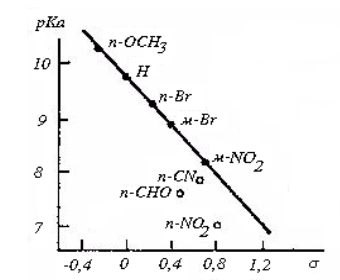
Рисунок 3. График диссоциации бензойных кислот с разными заместителями
Влияние заместителей на диссоциацию замещенных 3-фенилпропионовых и фенилуксусных кислот
Диссоциация замещенных $3$-фенилпропионовых кислот:
Диссоциация замещенных фенилуксусных кислот:
Бензольное кольцо с заместителем $X$ от карбоксильной группы будет отдалено на одну или две группы -$CH_{2-}$ (метиленовые группы).
Для всех серий кислот справедливы линейные корреляции (Рис. 2) и соответствует уравнение вида:
где $n=0,1$ или $2$.
Если $\sigma_{x=н}=0$, то
где $\rho $- наклон графика на рис. 3.

Рисунок 4. График зависимости кислотности замещенных фенилуксусной и фенилпропионовых кислот от кислотности бензойных кислот с одинаковыми заместителями
Для $ArCH_2COOH \rho=0,49$, для $ArCH_2CH_2COOH \rho=0,21.$
Применение уравнения Гаммета
Любое кислотно -- основное равновесие можно представить в виде уравнения:
где $K_0$-константа равновесия для незамещенного производного бензола;
$K_х$- константа равновесия для м- и п-замещенных производных бензола.
Величины $K_0$ и $K_х$ принадлежат одной и той же реакции.
Константа заместителя выступает как мера воздействия заместителя на константу кислотности бензойной кислоты.
Константа реакции $\rho $ является мерой чувствительности реакции к введению заместителя в бензольное кольцо. Мера чувствительности определяется относительно действия тех же заместителей на диссоциацию бензойной кислоты при $\rho $=1.
Уравнение Гаммета нашло хорошее применение при:
- анализе реакций производных бензола;
- диссоциации арилфосфоновых кислот;
- диссоциации ненасыщенных карбоновых кислот группы~фенилпропаноидов (бензилиденуксусная кислота, $\beta $-фенилакриловая кислота) и других реакций.












