
Влияние на карбкатионы (-I)- и (+I)-заместителей
$(-I)$-заместители стабилизируют карбанионы.
Йодистый тетраметилламмоний металлируется фениллитием $C_6H_5Li$. Тогда ион $(CH_3)_4N^+$ в роли $CH$-кислоты будет сильнее бензола:
$(CH_3)_4N^+-CH_3 + C_6H_5Li → (CH_3)_4N^+-CH_2^- + C_6H_6$
(+I)-заместители дестабилизируют карбанион вследствие уменьшения кинетической кислотности СН-связей в алканах:
\[CH_4 >перв-CH >втор-CH >трет-CH.\]Главным фактором, определяющим устойчивость арильных анионов $XC_6H_{4}^-$, является индуктивный эффект заместителя $X$. В таком анионе , несущая отрицательный заряд орбиталь не может находиться с ароматической $\pi $-системой в сопряжении.
На схеме молекулярно -- орбитального строения фенильного аниона $C_6Н_{5}^-$ показаны $\pi $-НСМО и орбиталь ($sp^2$) неподеленной электронной пары:
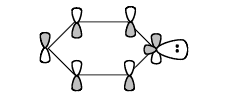
Рисунок 1.
$\pi $-НСМО расположена асимметрично относительно бензольного кольца, в то время как $sp^2$-орбиталь симметрична, то есть орбитали ортогональны друг другу.
Перекрывание снизу плоскости уравновешивается перекрыванием сверху плоскости. Тогда суммарный энергетический эффект равен нулю.
Заместитель $X$ ($-CN, \ -COR, \ -NO_2$) в замещенном анионе $XC_6H_{4}^-$ не может стабилизировать карбанион сопряжением, так как $sp^2$-орбиталь не может взаимодействовать с $\pi $-НСМО бензола. Стабилизация будет осуществляться в результате действия индуктивного эффекта заместителей.
При удалении от карбанионного центра индуктивный эффект быстро затухает, поэтому кинетическая кислотность бензолов с $(-I)$-заместителем будет убывать в последовательности:$\ {\rm орто}->мета->пара-$.
Дана реакция
$DC_6H_4X + KNH_2(NH_3) > C_6H_5X.$
Относительная кинетическая кислотность (для бензола $k_{отн}=1,00$):
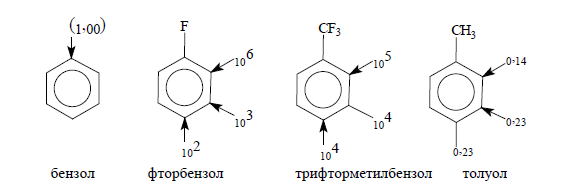
Рисунок 2.
В толуоле метильная группа имеет положительный индуктивный эффект, поэтому, по сравнению с бензолом, скорость замедляется. Наибольшее замедление проявляется в орто-положении.
Индуктивное влияние фенильных групп на кислотность
Индуктивный эффект может выражаться в системе с пирамидальной конфигурацией карбаниона, закрепленной наличием мостиковой системы:
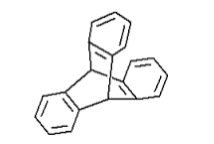
Рисунок 3.
Согласно шкале кислотности МСЭД для трифенилметана $pka=32,5$, для триптицена - $38$ и для метана - $40$.
У аниона триптицена ориентация орбиталей жестко закреплена, поэтому эффект делокализации заряда выражен незначительно. Индуктивное влияние в триптицене трех фенильных групп достаточно велико, чтобы вызвать увеличение кислотности около двух единиц по шкале МСЭД.
Индуктивный эффект и его взаимосвязь с эффектом сопряжения
Как правило, на стабилизацию карбанионов оказывают влияние факторы, которые состоят из суммы разных электронных эффектов. Чаще всего это индуктивный эффект и эффект сопряжения.
Многие ученые (Тафт, Кон и Джонс) пытались эти эффекты разделить. Они опирались на величины констант заместителей ($\sigma $-), полученных из значений рКа ряда мета- и пара-замещенных фенолов в воде при $25^\circ \ C$.
Параметр ${\sigma }^-_n$ разделили на резонансную (${\sigma }^-_R$) и индуктивную (${\sigma }^-_I$) с использованием допущений:
Чем выше положительное значение $\sigma $-, тем больше стабилизация заместителем аниона.
В таблице показан относительный вклад индуктивного и резонансного эффектов в способность заместителя увеличивать кислотность фенолов:
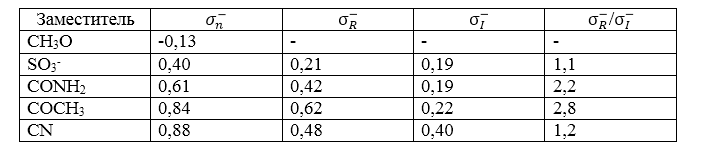
Рисунок 4.
Отношение ${\sigma }^-_R$/${\sigma }^-_I$ для групп, способных к сопряжению ($CONH_2, \ CN, \ COOC_2H_5, \ CHO, \ COCH_3, \ NO_2$) колеблется:
- цианогруппа -- $1,2$;
- ацетильная группа -- $2,8$.
Индуктивный эффект вносит большой вклад в суммарный эффект заместителя, в том числе для групп, способных наилучшим образом вступать с отрицательным зарядом в сопряжение.
Взаимосвязь индуктивного эффекта с эффектами сопряжения объяснили кинетические исследования по скорости изотопного обмена, катализируемого основанием.
Были изучены скорости изотопного обмена между рядом монозамещеннных ацетиленов и $D_2O$ в диметилформамиде в присутствии триэтиламина.
Водород в качестве заместителя можно сравнить с фенилом, что указывает на незначительную величину, действующего в обратном направлении эффекта сопряжения, который стремится рассредоточить положительный заряд по бензольному кольцу.
Близость кинетической кислотности фенилацетилена и ацетилена сильно контрастирует с различием почти в шесть единиц по шкале МСЭД.

Рисунок 5.
Ни в одном из заместителей делокализация отрицательного заряда не сводилась просто к эффекту сопряжения. n-Метоксифенильная и фенильная группы действуют одинаково. Это указывает на то, что электронодонорные свойства метоксигруппы почти полностью убирают дополнительный индуктивный эффект, которым она обладает.
Если метоксигруппа находится в непосредственной близости с тройной связью, то она увеличивает скорость обмена по сравнению с ацетиленом в три раза.
Сравнение скоростей мета- и пара-галогенфенилацетиленов указывает на то, что эффект сопряжения электронных пар атомов галогена накладывается на их индуктивный эффект.











