
Реакции электрофильного замещения имеют большое препаративное значение. С их помощью в ароматическое ядро могут быть введены, галогены, нитро- и сульфогруппы, алкильные и ацильные радикалы и некоторые другие заместители. С помощью реакции электрофильного замещения в молекулы ароматических соединений также могут быть введены изотопы водорода - дейтерий и тритий.
Реакция обмена водорода является простым примером реакции электрофильного ароматического замещения, в которой электрофильным реагентом являются изотопы водорода - дейтерий или тритий.
Эксперементально было подтверждено, что реакции электрофильного замещения идут по механизму $S_E(Ar)$, то есть по схеме присоединения-отщепления.
Механизм $S_E(Ar)$ универсален для реакции любых субстратов с любыми электрофилами, однако, в рамках этого механизма любые конкретные процессы имеют свои характерные отличия. Эти отличия обусловлены тем фактом, что процессы $S_E(Ar)$ включают последовательные стадии. В простейших cлучаях - две: арен - аренониевый ион и аренониевый ион - продукт замещения. Поэтому наблюдаемые скорости в зависимости от конкретных реакций можгут быть связаны со скоростями разных стадий.
Особенности протонирования бензола и его производных
Бензол является очень слабым основанием, значительно слабее, чем алкены. Однако бензол все же способен растворятся в концентрированных безводных кислотах. Бензол частично протонируется в концентрированной серной кислоте, тогда как изобутилен в значительной степени протонируется даже в ее водном растворе.
Реакция протонирования бензола подчиняется обычным закономерностям, харак¬терным для электрофильного замещения, например правилам ориентации. Так при наличии алкильных заместителей происходит заметное протонирование, которое может быть значительным. Например, гексаметилбензол протонируется на $50\%$ в $90\%$-ной серной кислоте.
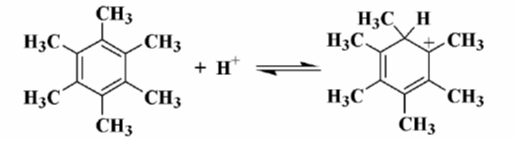
Рисунок 1.
Изотопный обмена водорода
Протонирование бензола можно обнаружить с помощью изотопного обмена водорода в кислоте. Если бензол перемешивать несколько дней при комнатной температуре с $80\%$-ной водной серной кислотой, содержащей дейтерий или тритий, изотопы водорода распределяются между бензолом и водной кислотой.
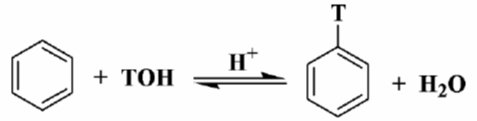
Рисунок 2.
Выбор изотопов водорода для обмена
-
Тритий обычно применяют как радиоактивный меченый атом с обычным водородом, в соотношении которое составляет менее одной миллионной доли. Радиоактивность трития может быть измерена таким чувствительным инструментом, как жидкостный сцинтилляционный счетчик. Следовательно, содержание трития можно точно измерить только при малых количеств изотопа.
-
Напротив, дейтерий используется как макроскопический изотоп. Его вхождение вместо протия (обычного водорода) контролируется менее чувствительными аналитическими методами, такими как ЯМР или масс-спектрометрия. Реакция обмена дает смеси дейтерированных бензолов, содержащих различные количества атомов дейтерия, соединенных с кольцом. Количество дейтерия, который прореагировал, будет зависеть от соотношения изотопов $^1H$ и $^2H$. В При использовании большего избытка дейтерокислот, такой как $D_2SO_4$ и дейтериевой воды $D_2O$ происходит замена на дейтерий одного за другим всех атомов водорода, т.е. в такой реакции можно получить полностью дейтерированный бензол - $C_6D_6.$
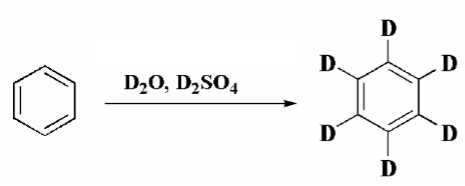
Рисунок 3.
Эти реакции обратимы, поэтому для получения максимально дейтерированных соединений необходимо использовать избыток кислот.
Потеря протона или изотопа в промежуточном катионе
Промежуточный пентадиенильний катион подвергается только одной реакции - потере протона (или дейтрона). Реакция в которой восстанавливается ароматическая π-система, является более быстрой, чем реакция с водой. В алкильных катионах взаимодействие с нуклеофильными частицами является намного более важной реакцией, потому что отщепление протона от таких карбокатионов не имеет такой дополнительной "движущей силы", как образование ароматического кольца.
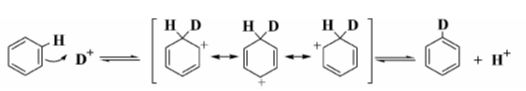
Рисунок 4.











