Устойчивые атомные орбитали, используемые для образования связи, называются валентными орбиталями. Процесс образования химической связи по теории молекулярных орбиталей на примере простейшей молекулы — молекулярного иона водорода $Н_2+$, содержащего один электрон и два протона, заключается в следующем. Каждый атом водорода в молекулярном ионе водорода имеет одну валентную $1s$-орбиталь. Между ядрами находится область перекрывания этих атомных орбиталей (см. рис. 1, а).
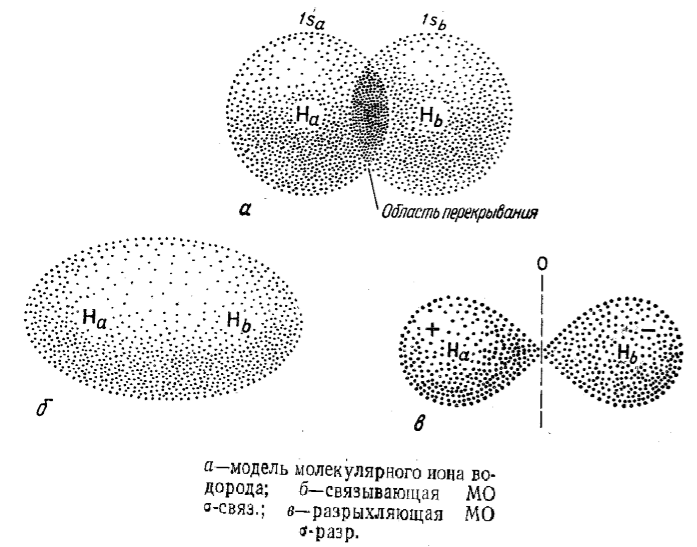
Линейная комбинация обоих атомных $1s$-орбиталей осуществляется двумя способами:
а) Сложение $1s$-орбиталей. При этом электрон значительное время проводит в области перекрывания между ядрами $Н_a$ и $Н_b$, поэтому между ними создается повышенная электронная плотность и сила притяжения между ядрами и электронами становится значительной, возникает молекулярная орбиталь, охватывающая оба ядра. Подобная орбиталь обладает более низкой энергией (поэтому более устойчива), чем атомные $s$-орбитали, и называется связывающей молекулярной $δ$-орбиталью (δ-связ.). Электрон на молекулярной орбитали $δ$-связи более устойчив, чем на $s$-орбитали изолированного атома. Эта орбиталь симметрична относительно оси, проходящей через оба ядра, и ее внешний вид не изменяется при любом повороте, поэтому она обладает цилиндрической симметрией. Связь, образованная $δ$-связывающей орбиталью, называется $δ$-связью (рис. 1, б).
б) Вторая возможность построения линейной комбинации состоит в вычитании атомных $1s$-орбиталей водорода друг из друга. При этом электрон никогда не будет находиться между ядрами $Н_a$ и $Н_b$ и будет преимущественно располагаться вне области перекрывания. Поэтому электронная плотность в пространстве между ядрами будет понижена, а в середине равна нулю, и между ядрами будет преобладать электростатическое отталкивание. Возникающая здесь молекулярная орбиталь имеет более высокую энергию, чем атомные $s$-орбитали и молекулярная связывающая орбиталь, и электрон на ней будет менее устойчив, чем на молекулярной $δ$-связывающей орбитали и $s$-орбитали изолированного атома. Эта орбиталь обладает цилиндрической симметрией и является $δ$-орбиталью, но уже разрыхляющей молекулярной орбиталью ($δ$-разр.), имеющей узел в области между атомами (рис. 1, в). При вращении по продольной оси проекция не изменяется.
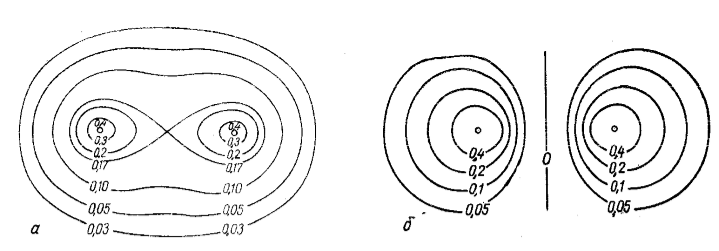
Рисунок 2. Кривые равных электронных плотностей: а—связывающая орбиталь; б—разрыхляющая орбиталь
Распределение электронных плотностей молекулярного иона водорода
Распределение электронных плотностей связывающих и разрых-ляющих молекулярных орбиталей нетрудно представить при помощи графиков, показывающих поперечные сечения поверхностей равных электронных плотностей (рис. 2, а, б). Соотношение энергий орбиталей иона $Н_2+$ наглядно выражается схемой (рис.3).
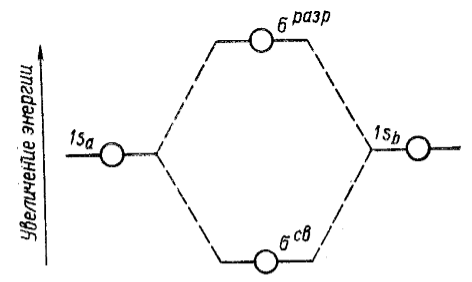
Рисунок 3. Схема энергий орбиталей молекулярного иона водорода
При образовании двухэлектронной связи две атомные орбитали также линейно комбинируются с образованием молекулярных орбиталей — связывающей и разрыхляющей. Процесс образования связывающей молекулярной орбитали на примере молекулы водорода, когда два электрона движутся в поле двух ядер, качественно описывается следующим образом: если два атома, имеющие по одному электрону с противоположно направленными спинами, постепенно сближаются, то между ними начинают действовать силы притяжения; на близком же расстоянии возникают силы отталкивания, которые быстро возрастают; на определенном расстоянии эти силы уравновешиваются и возникает ковалентная связь (рис. 4).
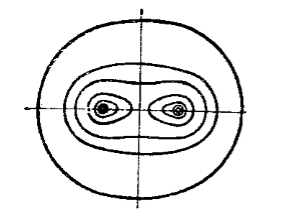
Рисунок 4. Распределение электронной плотности при образовании ковалентной связи в молекуле водорода (замкнутые линии означают равные электронные плотности)
Происходящие при этом изменения энергии показаны на рисунке 5. Минимум кривой потенциальной энергии отражает равновесное межъядерное расстояние — длину связи. Энергия связи имеет отрицательное значение, так как для ее разрыва требуется затрата энергии.
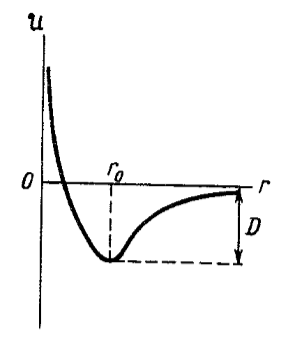
Рисунок 5. Кривые потенциальной энергии
$U$ — потенциальная энергия; $r$ — межъядерное расстояние; $r_0$ — равновесное межъядерное расстояние; $D$ — энергия связи.












