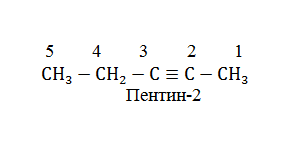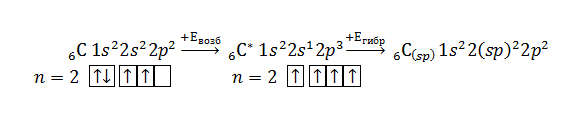Номенклатура ацетиленовых углеводородов
Алкины – это ненасыщенные алифатические углеводороды, имеющие одну или несколько тройных углерод-углеродных связей. Алкины с одной тройной связью образуют гомологический ряд, имеющий общую формулу $CnH_{n-2}$ (табл. 1).
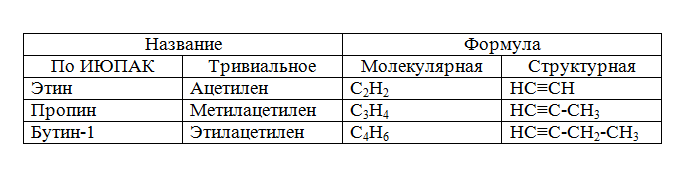
Простейшим представителем данного класса органических соединений является ацетилен $HC≡CH$, поэтому алкины часто называются ацетиленовыми углеводородами. Наличие тройной углерод-углеродной связи в названии соответствующего органического соединения по международной номенклатуре ИЮПАК обозначается суффиксом -ин-. Классовым изомером ацетиленовых углеводородов являются диеновые углеводороды.
Гомологический ряд ацетиленовых углеводородов:
Для ацетиленовых углеводородов характерна изомерия положения кратной связи (на письме обозначается номером атома углерода, участвующего в образовании кратной связи), а также изомерия углеродного скелета молекулы. Нумерация атомов углерода в молекуле алкена начинается с того конца, к которому наиболее близко расположена тройная связь:
Однако если в молекуле одновременно присутствуют двойная и тройная связи, при нумерации атомов углерода отдается предпочтение двойной связи.
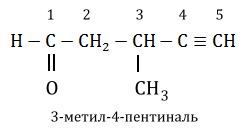
Если имеется другая функциональная группа, такая как $-OH$, $-CHO$, $-COOH$ и др., именно она определяет начало нумерации:
Строение ацетиленовых углеводородов
В молекуле алкинов атомы углерода, образующие тройную связь, находятся в $sp$-гибридизации:
Распределение электронной плотности в $sp$-гибридизованном атоме углерода:
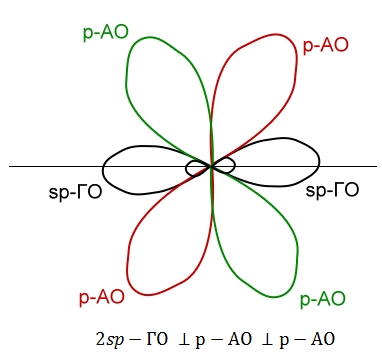
Исходя из распределения электронной плотности в $sp$-гибридизованом атоме углерода молекула простейшего алкина – ацетилена – является линейной. Соответственно, тройные связи $-C≡C-$ имеют линейное строение. Длина связи $-C≡C-$ составляет 0,120 нм, энергия связи – 828 кДж/моль.
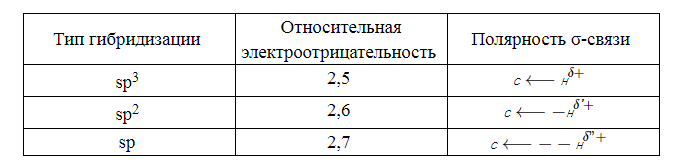
$\pi$-связи в молекуле ацетилена образуются путем попарного перекрывания $р$-атомных орбиталей. Благодаря их наличию для ацетилена и его гомологов характерны реакции замещения атома водорода вблизи кратной связи, а также реакции присоединения, что обусловлено величиной относительной электроотрицательности атома углерода в $sp$-гибридизации: атом водорода, непосредственно связанный с углеродным атомом в $sp$-гибридизации, обладает высокой подвижностью (табл. 2).
Относительные электроотрицательности атома углерода в различных валентных состояниях:
Физические свойства алкинов
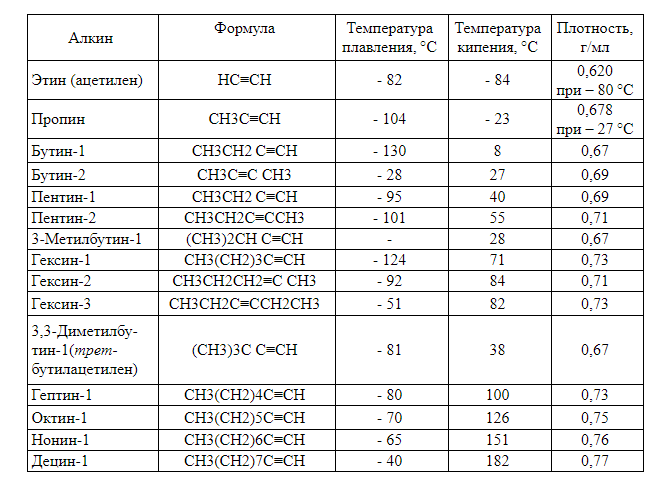
Низшие алкины, содержащие 2 – 4 атома углерода в нормальных условиях находятся в газообразном состоянии, от 5 до 16 – жидкости, свыше 16 – твердые вещества. С увеличением молекулярной массы алкинов растут и их температуры плавления и кипения (табл. 3). Подобно алкенам и алканам углеводороды ацетиленового ряда нерастворимы в воде, но растворимы в неполярных растворителях.
Физические свойства алкинов:
Применение алкинов
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём для производства растворителей, каучуков, синтетических волокон, клеев, уксусной кислоты, ацетона, лаков и пластификаторов.
При горении ацетилен выделяет большое количество теплоты, что используется для высокотемпературной резки и сварки металлов.
В начале XX века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил карбид кальция). В наши дни ацетиленовые фонари производятся в небольших количествах как походное снаряжение.