Радикальный механизм хлорирования метана, аналогичен и для реакций с остальными галогенами. Для всех галогенов это цепной радикальный процесс, который инициируется гомолизом молекул галогенов с образованием атомов галогена. Как и следовало ожидать, реакционная способность значительно уменьшается в ряду $F_2 > Cl_2 > Br_2 > I_2$. Энтальпии последовательных стадий галогенирования метана до $CH_3X$ приведены на рис.1
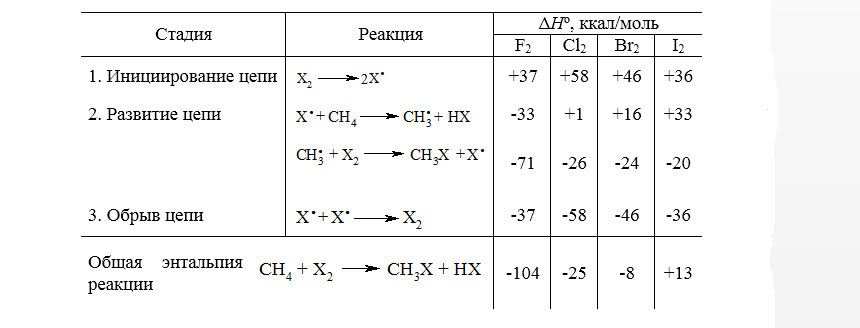
Рисунок 1. Энтальпии отдельных стадий галогенирования метана
Как видно по данным таблицы, относительные реакционные способности галогенов согласуются как с суммарными значениями $\Delta H^\circ$ всего процесса галогенирования в целом, так и со значениями $\Delta H^\circ$ для стадий развития цепи. Это обычный результат для радикальной реакции в газовой фазе.
Бромирование метана
Бромирование по сумме всех стадий - экзотермический процесс, но уже для первой взаимодействия на стадии роста цепи необходимо предоставить примерно 59 кДж / моль (взаимодействие эндотермическая) в отличие от фторирования и хлорирования (рис. 1):
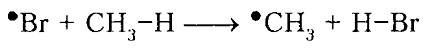
Рисунок 2. Бромирование, йодирование и фторирование метана
Энергия активации при этом равна примерно 75 кДж / моль. Поэтому только атомы брома с высокой энергией способны преодолеть высоту энергетического барьера и прореагировать с метаном.
Общая, при небольших температурах, скорость бромирования значительно меньше по сравнению с хлорированием (примерно в 250 000 раз). Однако реакция бромирования происходит с высокой селективностью.
Бромирование благодаря низкой среди галогенов экзотермичности ($\Delta H- 29$ кДж / моль) и меньшей энергии свободного радикала брома происходит более селективно и дает почти чистые продукты. Известно, что селективность тем больше, чем меньше реакционная способность агента галогенирования.
Легче галогенирования происходит в третичного атома углерода, затем - вюринного и, в конце, - первичного. Для Брома соотношение скоростей замещения в этих атомов 1600: 82: 1.
Высокую селективность бромирования связывают с медленным течением реакций, а также ее кинетическим контролем.
Бромирование метана происходит с меньшим выделением энергии, чем хлорирование. На первой стадии развития цепи наблюдается высокий эндотермический эффект: $\Delta H^\circ_1 = +16$ ккал/моль (при хлорировании $\Delta H^\circ_1 = +1$ ккал/моль). Это означает, что свободная энергия активации $\Delta G_1^\neq$ для первой стадии должна быть намного выше, чем для хлорирования. Действительно, $\Delta G_1^\neq$ для первой стадии развития цепи (18 ккал/моль; рис. 1) при бромировании намного превышает $\Delta G_1^\neq$ для хлорирования (4 ккал/моль). Тепловые эффекты второй стадии развития цепи при бромировании (- 24 ккал/моль) и при хлорировании (- 26 ккал/моль) весьма близки и энергия активации $\Delta G_2^\neq$ для обоих процессов тоже очень мало различаются. Значительно более высокое значение $\Delta G_1^\neq$ для бромирования указывает на то, что бромирование метана протекает с меньшей скоростью, чем хлорирование.
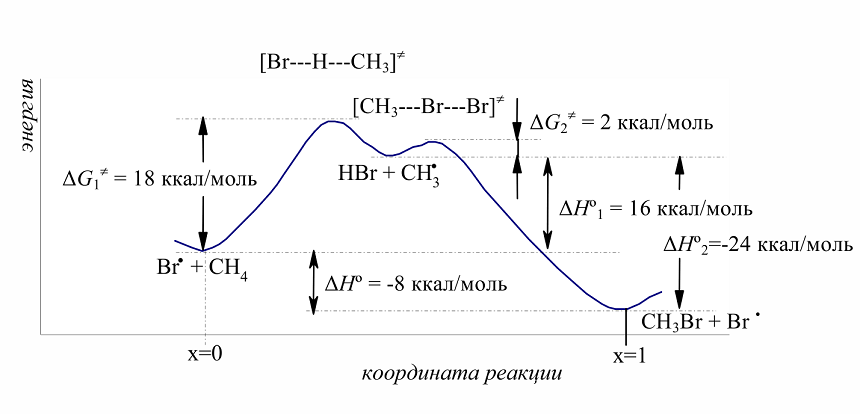
Рисунок 3. Энергетическая диаграмма свободнорадикального бромирования метана
Йодирование метана
Йодирования алканов проходит с очень малой скоростью нуждается в дополнительной энергии (процесс эндотермический), а образованный $HI$ активно восстанавливает йодалкилы снова в алканы. Только применяя специальные йодирующие агенты, например трет-бутоксийодид полученный из йодида ртути $HgI_2$ действием тpeт-бутоксихлорида, возможно йодирование алканов с небольшими выходами.
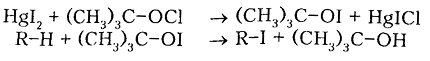
Рисунок 4. Бромирование, йодирование и фторирование метана
Применяют также реакцию обмена хлора в хлоралкане йодом под действием йодида натрия NaI в ацетоновом растворе - реакция $X$. Финкельштайна, 1910 гг.:
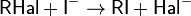
Рисунок 5. Бромирование, йодирование и фторирование метана
Реакции Финкельштайна способствует большая растворимость NaИ в ацетоне сравнению с хлоридом натрия.
Фторирование метана
Взаимодействие алкана непосредственно с фтором происходит со взрывом в результате значительного экзотермии (выделение теплоты). Так, при монофторировании метана для разрыва одной $C-H$-связи и связи $F-F$ необходимо потратить соответственно 425 и 160 кДж / моль (рис. 1):
$H_3C-H+F-F \Longrightarrow H_3C-F+HF$, $\triangle H=-437$
Одновременно с образованием новых связей $C-F$ и $H-F$ выделяется соответственно -452 и -570 кДж / моль. Суммарная теплота (экзотермии) реакции составляет $[-452 + (- 570)] - (160 + 425) = -437$ кДж / моль.
Для разрыва $C-C$-связи необходимо примерно 350 кДж / моль, поэтому непосредственное фторирование происходит со взрывом:
$CH_3-CH_2-CH_3+4F_2 \longrightarrow 3C_{\underline{Сажа}} + 8HF$
Во избежание сильной экзотермии фтор разводят жидким азотом или проводят реакцию в растворителе - полностью фторированных алканах:
$CH_3-CH_3+6F_2 \longrightarrow CF_3 - CF_3 + 6HF$
Разбавления фтора азотом дает возможность добывать полифторпроизводные алканов с достаточно высоким выходом:
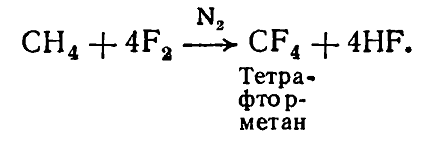
Рисунок 6. Бромирование, йодирование и фторирование метана
Направленое фторирование алканов без разрыва связей $C-C$ также проводят кобальт (III) фторидом или фтором, который выделяется при электролизе. Через слой $CoF_3$ пропускают газообразные алканы, при этом образуется перфторалканы и фторид кобальта (II):
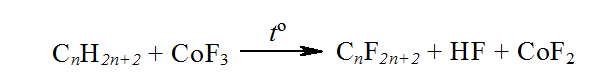
Рисунок 7. Бромирование, йодирование и фторирование метана
Фторид кобальта (II) регенерируют, пропуская через через него ток фтора.












