Общие положения
Молекула -- это самостоятельная частица, устойчивая, электрически нейтральная. Химическая устойчивость молекул относительна, она возможна в тех системах, где расстояния между молекулами намного больше их собственных размеров. Между соседними молекулами возникает взаимное притяжение уже на расстоянии в один нанометр. Начинают действовать электростатические силы притяжения (силы Ван -- дер -- Ваальса) и, иногда, возникает донорно -- акцепторное взаимодействие.
Электростатическое притяжение
Межмолекулярное электростатическое притяжение называют силами Ван -- дер -- Ваальса. Они имеют ряд отличий от химических связей, так ка они:
-
электрической природы;
-
слабые;
-
проявляются на больших расстояниях;
-
ненасыщаемы.
Электростатическое притяжение характеризуется тремя типами межмолекулярного взаимодействия:
-
Ориентационное (диполь -- дипольное) взаимодействие. Характеризуется взаимной ориентацией разноименнозаряженных полюсов полярных молекул при их приближении друг к другу (Рис.1 ). Энергия такого взаимодействия определяется электрическим дипольным моментом молекул. Чем выше дипольный момент и меньше расстояние между молекулами, тем больше энергия взаимодействия.
-
Индукционное взаимодействие. Обусловлено электростатическим взаимодействием полярной и неполярной молекул (Рис. 1). Полярная молекула своим полем воздействует на неполярную, в результате чего появляется наведенный (индуцированный) диполь, способный притягиваться к диполю полярной молекулы. Индуцированный диполь усиливает дипольный момент полярной молекулы. Энергия такого взаимодействия определяется электрическим диполем полярной молекулы и поляризуемостью неполярной молекулы.
-
Дисперсионное взаимодействие. Появляется как результат притяжения мгновенных диполей (микродиполей). Такие диполи появляются, если не совпадают электрические центры тяжести электронного облака и ядер, что вызвано их независимыми колебаниями. Одновременное появление и исчезновение микродиполей молекул сопровождается их притяжением. Если синхронность отсутствует, происходит отталкивание. Дисперсионное взаимодействие может проявляться между любыми молекулами, а потому является универсальным.
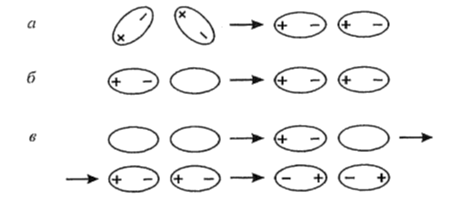
Рисунок 1. Типы межмолекулярного взаимодействия: а - ориентационное, б- индукционное, в - дисперсионное
Величина энергий отдельных частей системы в общую энергию межмолекулярного взаимодействия зависит от полярности и поляризуемости молекулы.
Донорно - акцепторное взаимодействие
Донорно - акцепторное взаимодействие образуется за счет электронной пары одной молекулы и свободной орбитали другой. Это взаимодействие:
-
проявляется в первичных процессах многих химических реакций;
-
обусловливает сольвацию молекул и ионов в растворе;
-
лежит в основе каталитических процессов;
-
приводит к образованию новых соединений.
Образование межмолекулярного комплекса состава $BF_3 \cdot NH_3$ из молекул $BF_3$ и $NH_3$:
$H_3N^{\delta -} - B{\delta +} F_3 \to H_3N \cdot BF_3$
Атом бора в $BF_3$ положительно поляризован, имеет свободную орбиталь и выступает в качестве акцептора. В качестве донора выступает отрицательно поляризованный атом азота $NH_3$ (Рис. 2)
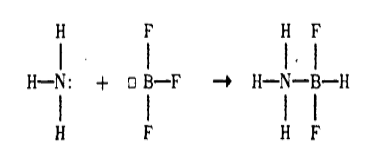
Рисунок 2. Донорно - акцепторное взаимодействие между $BF_3$ и $NH_3$
Энергия межмолекулярного донорно -- акцепторного взаимодействия может колебаться в широких пределах: от $6-12$ кДж/моль до $200-250$ кДж/моль.
Межмолекулярное донорно - акцепторное взаимодействие обусловливает переход вещества из одного агрегатного состояния в другое (из газообразного состояния в жидкое или твердое).
Молекула дифторида бериллия $BeF_2$ в газообразном состоянии имеет линейное строение.
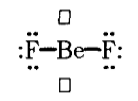
Рисунок 3.
Между молекулами $BeF_2$ возникает донорно -- акцепторное взаимодействие за счет свободных орбиталей атомов бериллия и неопределенных электронных пар атомов бора. Это становится возможным при понижении температуры. Молекулы $BeF_2$ ассоциируются с образованием полимера $Be_nF_{2n}$ -- кристалла $BeF_2$ (Рис. 3).
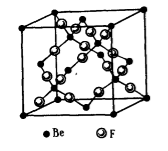
Рисунок 4. Структура кристалла фторида бериллия $BeF_2$
Межмолекулярная водородная связь
Водородная связь по прочности превосходит силы Ван -- дер -- Ваальса, ее энергия составляет $8-40$ кДж/моль. Эта связь характерна для соединений водорода с наиболее электроотрицательными элементами:
-
фтором ($25-40$ кДж/моль);
-
кислородом ($13-29$ кДж/моль);
-
азотом ($8-21$ кДж/моль);
-
в меньшей степени -- с хлором и серой.
Чем выше электроотрицательность и меньше размеры атома, тем выше энергия связи.
Водородная связь образуется в результате способности положительно поляризованного атома водорода внедряться в электронную оболочку (не связанного с ним ковалентно) отрицательно поляризованного атома. В результате этого наряду с электростатическим и донорно -- акцепторным взаимодействием возникает водородная связь.
Водородная связь важна при:
-
ассоциации молекул;
-
образовании кристаллогидратов;
-
процессах растворения, кристаллизации;
-
электролитической диссоциации и др.
Например: молекулы фторида водорода в любом агрегатном состоянии ассоциированы в зигзагообразные цепочки вида:
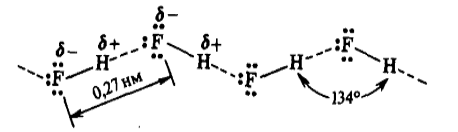
Рисунок 5.
что обусловлено водородной связью.
Водородные связи легко возникают и легко разрываются при комнатной температуре вследствие своей непрочности.
Межмолекулярные водородные связи приводят к изменению некоторых свойств веществ. Повышаются:
-
вязкость вещества;
-
температура кипения и плавления;
-
теплоты плавления и парообразования;
-
диэлектрическая постоянная.












