
Теория электронных смещений представляет собой совокупность гипотез о статических и динамических смещениях электронов в молекулах, ионах и радикалах. Все предложенные и принятые в рассматриваемой теории внутримолекулярные смещения электронов можно разделить на:
-
Смещения вдоль связей с сохранением электронного дублета и смещения со связи на связь т.е. по индукционному и таутомерному механизмам соответственно;
-
Смещения в основном состоянии молекулы и смещения под действием внешних факторов, т.е. статическое и динамическое смещение соответственно.
Статическое смещение, идущее по индукционному механизму, называется индукционным, а аналогичное динамическое смещение называется индуктомерным. Статическое смещение по таутомерному механизму называется мезомерным, а аналогичное динамическое смещение -- электромерным.
Основные типы химической связи
Различают два крайних случая расположения электронных пар между атомами. В первом случае электронные пары располагаются на одинаковом расстоянии от ядер соединяющихся атомов. Такая связь называется атомной или ковалентной неполярной, во втором случае электронные пары принадлежат одному из атомов, такая связь называется ионной. Если электронная пара лишь несколько оттянута к одному из атомов, такая связь называется ковалентной полярной.
Образование различных типов валентной связи зависит от способности атомов притягивать или отдавать электроны. Атомы металлов, имеющие на наружном электронном слое небольшое число электронов, легко отдают их. Атомы неметаллов, имеющие на внешнем электронном слое большое число электронов, легко их принимают. Поэтому при соединении атомов металлов с атомами неметаллов образуется обычно ионная или сильно полярная связь. Т.е. и металлы, и неметаллы стремятся приобрести полностью заполненную внешнюю электронную оболочку. При соединении атомов неметаллов друг с другом возникает ковалентная связь с различной степенью полярности.
Понятие электроотрицательности
Характеристикой способности атома притягивать к себе электронную пару является его электроотрицательность (ЭО), которая позволяет учесть способность нейтрального атома как к присоединению электрона, так и к его отдаче. Она обозначается греческой буквой $\chi $ («хи»), при этом $\chi = \ ^1/_2\ (J_1 + E)$, где $J_1$ -- первый потенциал ионизации и $Е$ -- сродство к электрону. Базируясь на энергетических характеристиках процессов присоединения электрона к нейтральному атому и его отдачи, ЭО является обобщенной характеристикой, позволяющей более строго количественно описать свойства атомов элементов. Наименьшие значения ЭО имеют атомы щелочных металлов, наибольшие -- атомы галогенов и благородных газов (рис. 1).
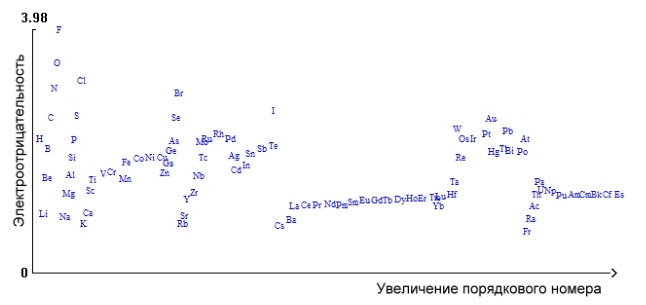
Рисунок 1. Зависимость ЭО от порядкового номера элемента
Обычно используют шкалу относительных электроотрицательностей по Л. Полингу, в которой ЭО ($Li$) равна $1$, а ЭО ($F$) принята равной $4$. Существует также шкала ЭО по Малликену, в основу которой положены величины $\chi $, для вычисления которых значения $J$ и $Е$ получены с использованием так называемых орбитальных радиусов атомов, т.е. рассчитанных методами квантовой механики радиусов главных максимумов радиальной плотности электронов (табл. 1).
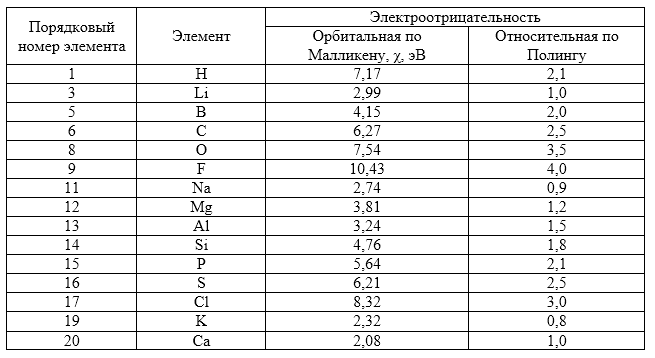
Рисунок 2. Электроотрицательность некоторых элементов
Потенциалы ионизации (энергии ионизации), сродство к электрону и ЭО измеряются обычно в электронвольтах (эВ) или в килокалориях ($1$ккал = $4,1840$ кДж), $1$эВ = $1,6 \cdot 10^{-12}$ эрг = $23060$ кал/моль = $96,48$ кДж/моль.
Квантовомеханическое описание поведения элементарных частиц включает в себя принцип неопределенности Гейзенберга. Согласно этому принципу, невозможно одновременно точно определить координату частицы, например, положение электрона в атоме, и ее импульс $P = mv$. Соотношение неопределенностей в координате $\Delta x$ и импульсе $\Delta P_x$ записывается так:
где символ $\Delta $ означает неопределенность.
Определение типа химической связи
Пара электронов смещается к тому из атомов, который обладает большей электроотрицательностью ($\chi $). Для заключения о вероятном типе образуемой химической связи нередко используют величину разности относительной ЭО по Полингу атомов, образующих связь ($\Delta $$\chi $). Так, если $\Delta \chi = 0$, то связь ковалентная неполярная ($H_2$, $O_2$, $N_2$). Если величины $\Delta \chi > 0$, то связь ковалентная полярная. При этом, чем больше эта разность, тем выше процент ионной связи:
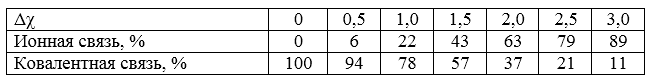
Рисунок 3.
Таким образом, резкой границы между ковалентной полярной и ионной связью нет, переход от одного типа связи к другому происходит постепенно, по мере смещения электронной пары к одному из участников образования связи.
Указать тип химической связи в молекулах $KBr$, $CO$, $N_2$, $SiO_2$.
Решение. Воспользуемся таблицей ЭО. Вычисленные величины $\Delta $$\chi $ позволяют заключить, что в молекуле $N_2$ связь ковалентная неполярная ($\Delta \chi = 0$), в остальных молекулах -- ковалентная полярная с постепенным увеличением полярности (ионности) по ряду $CO
Графическое представление смещения электронных пар.
Рассмотрим молекулу $A-B$, в которой ЭО($B$) $>$ ЭО($A$). Электронная пара смещается в сторону более электроотрицательного атома. Таким образом, на атоме $A$ имеем частично положительный заряд $\delta^+$, а на атоме $B$ -- частично отрицательный заряд $\delta^-$. Если связь между атомами образована электронами $\sigma $-симметрии, т.е. в результате лобового перекрывания между атомными орбиталями (рис. 4 а), то смещение электронной пары изображается прямой стрелкой между атомами (рис. 5 а). Если связь образована электронами $\pi $-симметрии, т.е. в результате бокового (двойного) перекрывания $p$-орбиталей атомов (рис. 4.б), то смещение электронной пары изображается изогнутой стрелкой в направлении смещения электронной пары (рис. 5 б).
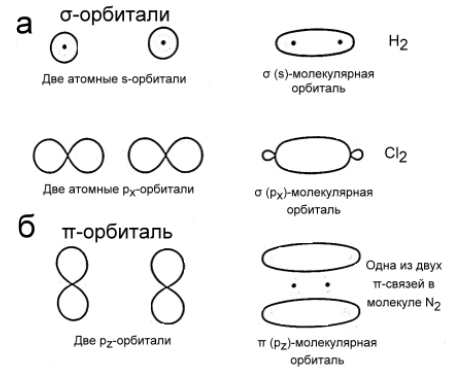
Рисунок 4. Схематическое изображение связывающих орбиталей
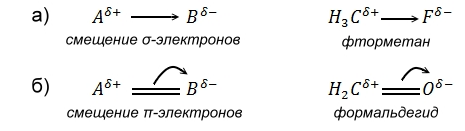
Рисунок 5. Схематическое изображение смещения электронной пары











