
Алициклическими (от алифатические циклические) называются такие углеводороды, молекулы которых содержат один или несколько циклов. Их еще называют циклоалканами (циклопарафинами) или циклоалкенами (циклоолефинами) в зависимости от отсутствия или наличия двойной связи.
Классификация циклических соединений
В зависимости от величины циклов, их количества и способа сообщения алициклические углеводороды делятся на моно-, би- и поли циклические соединения.
Самая большая группа циклических соединений - моноциклические. Их название начинается с префикса цикло-, и нумерацию проводят таким образом, чтобы заместители получили наименьшие номера. С целью упрощения написания формул циклические соединения условно изображают в виде геометрических фигур (треугольник, пятиугольник и т.д.):
По современной классификации циклоалканы разделяются на следующие группы:
-
малые циклы ($3-$ и $4$-членные);
-
нормальные циклы (от $5-$ до $7$-членных);
-
средние циклы (от $8-$ до $11$-членных);
-
большие или макроциклы ($12$-членные и больше)
Изомерия циклических соединений
Геометрическая изомерия в циклоалканах возникает благодаря жесткому расположению заместителей в цикле, в результате чего они не способны изменять свое положение относительно плоскости кольца. Необходимо учитывать, что циклоалканы, как правило, имеют не плоское, а пространственное строение в виде определенных конформаций.
Енантиомерия алициклических соединений возникает при наличии хирального атома углерода и отсутствия элементов симметрии, в первую очередь в плоскости симметрии. Например, $2,2$-диметил-циклобутан-карбоновая кислота имеет асимметрический центр и может существовать в виде пары энантиомеров.
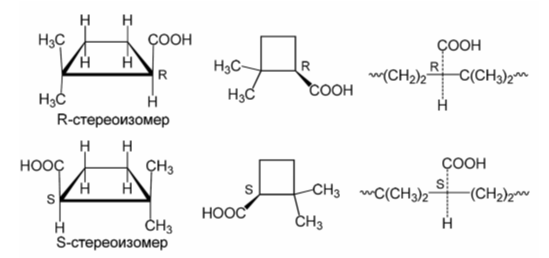
Рисунок 1.
$2$-метил-циклобутанкарбоновая кислота имеет два асимметрических центра, следовательно, в общем случае она может существовать в виде $4$-х стереоизомеров, среди которых $2$ пары энантиомеров ($1R$,$2S$ и $1S$,$2R$; $1R$,$2R$ и $1S$,$2S$) и $4$ пары диастереомеров.
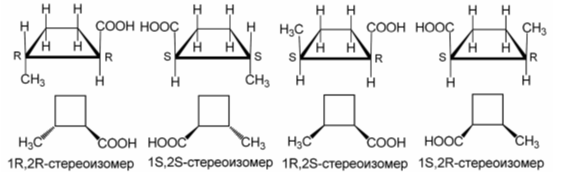
Рисунок 2.
В случае химически эквивалентных заместителей подобные циклические соединения могут существовать в виде пары энантиомеров и мезо-формы.
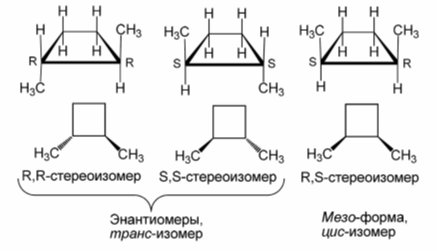
Рисунок 3.
Конформация циклоалканов связана с особенностями их строения. Как уже было отмечено, циклоалканы в действительности не является плоскими, а существуют в виде некоторых пространственных построений (конформеров).
Всего на внутреннюю энергию молекулы согласно теории коинформацийного анализа влияют в основном четыре главных фактора:
-
"байеровскоее" напряжение - обусловливает изменение валентных углов;
-
"питцеривское" напряжение - обуславливает инверсию (изменение конформации) цикла;
-
напряжение вследствие проявления внутримолекулярных вандерваальсевских сил отталкивания и сближения в пространстве заместителей;
-
напряжение связей - обусловливает изменение межъядерных расстояний.
Итак, любая молекула пытается приобрести такую конформацию, для которой сумма напряжений всех факторов, или энергия внутримолекулярных взаимодействий (энергия напряжения), была бы минимальной.
Таким образом, циклоалканы существуют в определенных пространственных конформациях. Только циклопропан имеет плоскую структуру. Для циклобутана структура молекулы несколько изогнута и находится в равновесном состоянии с плоским конформером вследствие инверсии (угол "складчатости" равен примерно $25^\circ$).
Рисунок 4.
Строение и свойства малых циклов
Моноциклоалканы $C_3-C_4$ представляют собой газы, начиная с $C_5$ - жидкости. Они характеризуются несколько более высокой температурой кипения, чем их алифатические аналоги, они малополярны и практически нерастворимые в воде.
Химические свойства циклоалканов в значительной степени зависят от устойчивости их циклов. Так, циклопропан, который имеет наименее устойчивый цикл, способен к реакциям присоединения с расщеплением цикла и по свойствам напоминает алкен.
Квантово-механические расчеты показывают, что в молекуле циклопропана реальный угол $C-C-C$ (а) между $sp^3$-гибридными орбиталями составляет не $60^\circ$, а $104^\circ$. В результате максимальное перекрытие орбиталей происходит не вдоль мижьядерной оси связи $C-C$, а несколько вне ее, вне сторон треугольника) с образованием слабой "бананоподобногй" связи, которая фактически является промежуточной между $\sigma $- и $\pi $-связями (рис. 5, а, А. Коулсон и Е. Моффит, $1947$ г.).
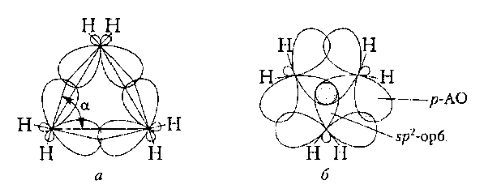
Рисунок 5. Схема образования связей в циклопропане: а - структура А. Коулсона и Е. Моффита, б - структура А. Уолша
Существует мнение о $sp2$-гибридном состоянии атома углерода и значительном вкладе $p-AO$ в образование бананоподибной связи (рис. 5, б, А. Уолш, $1949$ г.). Наличие такой связи и внутреннего "байеровского" напряжения приводит понижению внутренней энергии циклопропана по сравнению с другими циклоалканами и вызывает его высокую реакционную способность, подобную алкенам. Так, экспериментально определенная теплота образования (газа) составляет для: циклопропана $+53,3$ кДж / моль; циклобутана $-28,4$; циклопентана $-77,2$ и циклогексана $-123,4$ кДж / моль. Это означает условно, что циклизация пропана в циклопропан более эндотермических реакцией, которая нуждается в дополнительной энергии - энергии "напряжения" в сравнении с циклизацией гексана в циклогексана. Поэтому в реакциях, которые проходят с расщеплением пропанового цикла, высвобождается тот избыток энергии "напряжения", что и является проявлением его высокой реакционной способности.
Циклобутан менее напряженный и стойкий, чем циклопропан, однако его способность к реакциям присоединения преобладает способность к участию в реакциях замещения.
Наибольшую устойчивость проявляют пяти-, шестичленные и высшие циклы, для которых характерны реакции замещения, подобно алканам.











