Графическое построение молекулярных $\sigma$-орбиталей
Изменение энергии при образовании химической связи рассматривается с помощью энергетических диаграмм, аналогичных таковым для атомов. Энергию орбитали будем отмечать черточкой на соответствующей оси энергий. При заполнении МО орбиталей электронами соблюдаются те же три принципы что и для АО:
1) наименьшая энергия;
2) не более двух электронов на одной МО;
3) заполнение максимального числа МО, если они имеют одинаковую энергию.
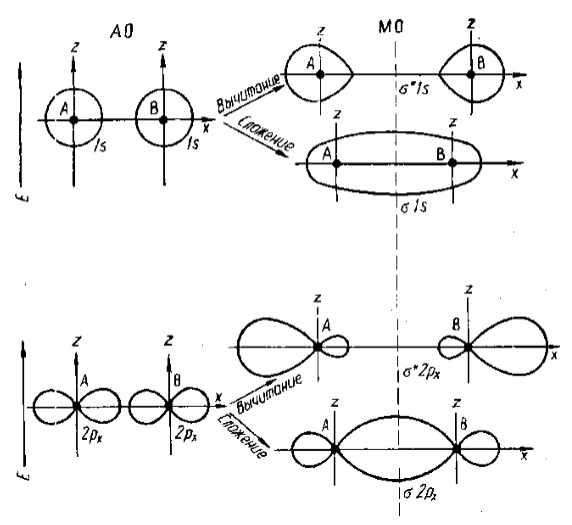
Рисунок 1. Образование связывающих и разрыхляющих $\sigma$- МО из исходных АО
Согласно этому методу молекулярные орбитали представляются в виде линейных комбинаций атомных орбиталей исходных атомов, т. е. как результат сложения и вычитания волновых функций характеризующих атомные орбитали. Так, для двухатомной молекулы АВ волновые функции МО являются линейной комбинацией атомных орбиталей.
Для примера рассмотрим молекулу $H_2$. На рис. 2 изображена ее энергетическая диаграмма.
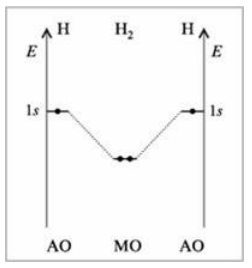
Рисунок 2. Энергетическая диаграмма молекулы $H_2$
Слева и справа на вертикальных осях энергии отмечены энергии перекрывающихся $1s$-АО двух атомов $H$, а посередине --- электроны на энергетическом уровне молекулы. Энергия МО ниже, чем исходных АО.
Разность энергий АО и МО, т.е. энергия, выделяющаяся при переходе электронов с АО на МО, является энергией связи.
Чтобы разорвать связь, т.е. вернуть электроны на исходные АО, необходимо такую же энергию затратить.
Энергия связи тем больше, а связь тем прочнее, чем выше электронная плотность между ядрами. Последняя, при прочих равных условиях, зависит от размеров соединяющихся атомов. Чем атомы меньше, тем выше электронная плотность на их АО, следовательно, и на образующихся МО.
На рис. 3 вверху показано перекрывание валентных $s$-АО атомов водорода, лития и натрия, а ниже -- соответствующие энергетические диаграммы двухатомных молекул.
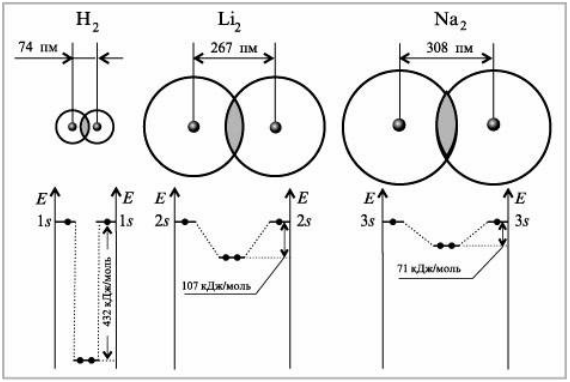
Рисунок 3. Перекрывание АО и энергетические диаграммы молекул $H_2$, $Li_2$, $Na_2$
И пусть вас не удивляют молекулы $Li_2$ и $Na_2$. Молекулы металлов существуют в газообразном состоянии, но они непрочны, т.к. образованы сравнительно большими атомами. Обратите внимание на значения энергии связи в молекулах $Li_2$ и $Na_2$ по сравнению с молекулой $H_2$ (их содержание и равновесная концентрация в парах малы).
Повышенная электронная плотность между ядрами может быть обеспечена не только двумя электронами, как в молекуле $H_2$, но и одним. И поистине простейшая молекула --- ион $H_2^+$. (Обычно молекулой называют электронейтральную частицу. Но при рассмотрении химической связи молекулой называют любую связанную электронно-ядерную систему, в том числе не только сложные ионы, но и кристаллы.)
Естественно, что электронная плотность между ядрами, т.е. в области перекрывания, в этой молекуле меньше, чем в $H_2$, следовательно, энергия связи ниже (она составляет $256$ кДж/моль) (рис. 4).
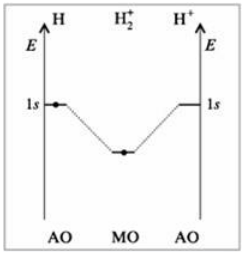
Рисунок 4. Энергетическая диаграмма иона $H_2^+$
Попробуем добавить электрон в молекулу $H_2$, т.е. рассмотрим ион $H_2^-$. На имеющейся МО третьему электрону места нет. И он занимает другую МО, на которой электронная плотность между ядрами понижена, как показано на рис. 5.
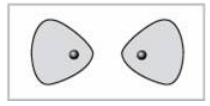
Рисунок 5. Распределение электронной плотности на антисвязывающей $s$ - МО
Такое распределение электронной плотности приводит к отталкиванию «обнаженных» ядер и повышению потенциальной энергии системы. Эта МО называется антисвязывающей (или разрыхляющей), ослабляющей связь, в отличие от ранее рассмотренной связывающей МО. Энергетическая диаграмма иона $H_2^-$ показана на рис. 6.
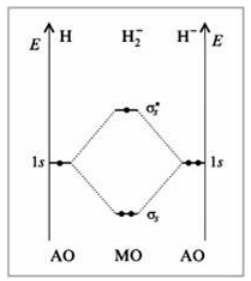
Рисунок 6. Энергетическая диаграмма иона $H_2^-$
На этой диаграмме приведены и принятые обозначения МО. В данном случае связь $-$, звездочка обозначает антисвязывающую МО.
Трехэлектронная связь в ионе $H_2^-$ слабая. Здесь на связывающей МО на один электрон больше, чем на антисвязывающей, как и в ионе $H_2^+$. Однако межэлектронное отталкивание (между тремя электронами) существенно уменьшает выигрыш в энергии. Энергия связи в молекуле-ионе $H_2^-$ составляет всего $17$ кДж/моль.
Это общее положение для соединений с трехэлектронными связями. Но именно такие связи образуются в соединениях благородных газов, у которых на всех АО имеется по два электрона. Поэтому их соединения неустойчивы.
Если в молекулу $H_2^-$ ввести еще один электрон, т.е. рассмотреть ион $H_2^{2-}$, то он займет место на антисвязывающей МО (рис. 7). Энергия связи равна $0$, и молекула не существует.
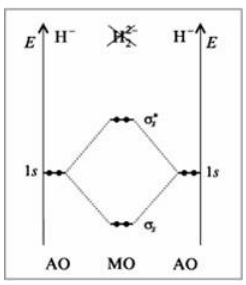
Рисунок 7. Энергетическая диаграмма иона $H_2^{2-}$
На рис. 8 показана энергетическая диаграмма гетеронуклеарной (т.е. содержащей ядра разных химических элементов) молекулы $HeH$. В отличие от уже рассмотренных молекул, образованных одинаковыми атомами (водорода), в этой молекуле исходные АО имеют разную энергию.
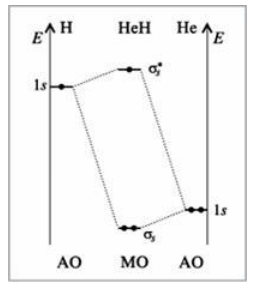
Рисунок 8. Энергетическая диаграмма молекулы $HeH$
Эта молекула существует, но очень неустойчива из-за большой разницы в энергиях перекрывающихся АО. Видно, что энергия связывающей МО мало отличается от энергии АО атома $He$, и переход электронов с АО на МО дает лишь очень малый выигрыш в энергии.











