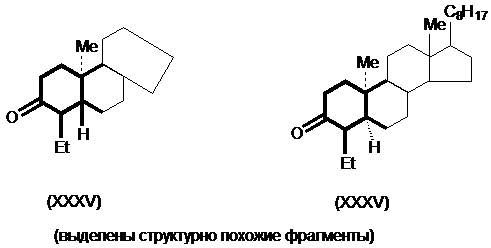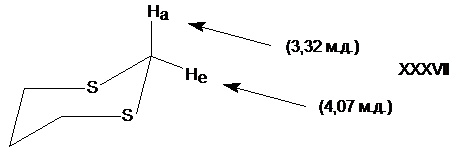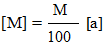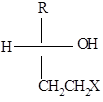Для получения относительных конфигураций веществ пригодны практически любые физические методы, применяемые в органической химии. Однако наиболее широкое распространение получили оптические методы (ДОВ и КД) и ЯМР спектроскопия.
Установление относительной конфигурации с помощью оптических методов
Простейшим путем использования оптических методов для установлений конфигураций заключается сравнение параметров ДОВ и КД в сериях где используются похожие соединения.
В качестве примера можно рассмотреть определение относительной конфигурации соединения XXXV и XXXVI. Экспериментально было показано, что знаки эффекта Коттона для этих двух соединений противоположны, но формы и интенсивности спектральной кривой одинаковы. Следовательно, можно сделать вывод, что соединения XXXV и XXXVI являются квази-энантиомерами в оптическом (но не в истинно структурном) смысле термина.
Рисунок 1.
В данном примере УФ- поглощения обусловлены карбонильными хромофорами, которые ахиральны. Тем не менее, наличие хирального окружения оказывает хиральные возмущающие действия на электронные переходы групп C=O, что позволяет установить относительную конфигурацию соединения.
Метод ЯМР-спектроскопии
Метод дает возможность характеризовать структуру органических веществ, в частности определять конфигурацию стереоизомеров. Вследствие получения сигналов от протонов соединения, ЯМР спектр содержит пики в виде синглетов, дублетов, триплетов и др:
Рисунок 2.
Разница между двумя пиками в Гц составляет константу спин-спинового взаимодействия (КССВ). Она дает возможность сказать какой изомер получили. КССВ для цис-формы лежит в пределах 4 ÷ 12 Гц, а для транс-формы - 12 ÷ 18 Гц. Изомеры с меньшими константами спин-спинового взаимодействия имеют цис-конфигурацию. Пример 1,2-диброметилен:
Рисунок 3.
Константу спин-спинового взаимодействия для его цис- формы j=4,7 Гц, для транс- формы j=11,8 Гц
При определениях относительной конфигурации методом ЯМР обычно используют химический сдвиг и константу спин-спинового взаимодействия. Так, в 1,3-дитиане (XVII) экваториальный атом водорода в положении 2 имеет более высокий химический сдвиг, чем водород в аксиальном положении. На основании этого легко возможно определить конфигурацию 2-замещенного дитиана.
Рисунок 4.
Константа спин-спинового взаимодействия (J) у вицинального протона в этановых фрагментах коррелируют с величиной соответствующего двугранного угла ϕ:
Рисунок 5.
На этом основании можно определить конфигурации, но только в ряде структурно-родственных соединений, так как величина J зависит и от природы заместителей.
Метод оптического сравнения
В основе метода оптического сравнения лежат два правила Чугаева:
-
величина молярного вращения в гомологическом ряду есть постоянная:
Рисунок 6.где М - величина молярного вращения;
-
химические превращения, которые осуществляются не у соседних атомов с центром хиральности очень мало влияют на величину молярного вращения. Это правило часто называют «правилом близости». Например, многие соединения общей формулы
Рисунок 7.имеют правое вращение независимо от природы заместителя X (H, Hal, NH2, COOH, CCONH2).
Метод оптического сравнения, развитый Фрейденбергом, базируется на использовании следующих закономерностей, непосредственно вытекающих из правил Чугаева:
- аналогичные соединения одинаковой конфигурации имеют подобные изменения оптического вращения, если в них проводятся одинаковые химические изменения (правило оптического смещения);
- оптическое вращение подобно построенных соединений одинаковой конфигурации имеют одинаковые изменения под действием растворителя, температуры и других факторов.
Используя метод оптического сравнения, Фрейденберг установил конфигуративно связь гидрокси- и аминокислот. Сравнение было выполнено, например, для пары L-(-)-яблочной кислоты и аспарагиновой кислоты. Сравнивались диэтил эфиры различных O- (или N-) производные этих кислот.
По полученным данным, ученый сделал вывод, что в ряде производных L-(-)- яблочной кислоты постепенно увеличивается левое вращение, а в ряде производных (+)- аспаргиновой кислоты тот же «сдвиг в лево» проявляется в уменьшении правого вращения и потом в нарастании левого вращения. Таким образом, (+)- аспаргинова кислота имеет подобную конфигурацию с L -(-)- яблочной кислотой.
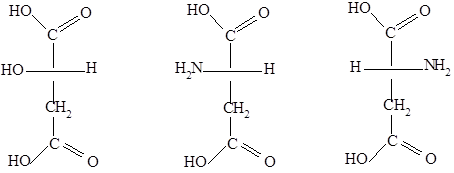
Рисунок 8. Слева направо: L-(-)-яблочная к-та, L-(+)-аспаргиновая к-та, D-(-)- аспаргиновая к-та. Автор24 — интернет-биржа студенческих работ
Для установления конфигурационного сходства, важно не совпадение вращения по знаку, не увеличение или уменьшение их, а само направление смещения (вправо или влево) в ряду производных, одинаковом для сравниваемых соединений.