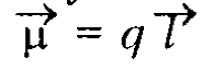Энергетически неравноценные геометрические формы молекул, которые переходят друг в друга при вращении частей молекул вокруг простых $σ$-связей, называют конформациями, или конформерами (от лат. Conformis - подобный), а также поворотными изомерами. Изучение особенностей и условий существования поворотных изомеров получило название конформационного анализа. Определение пространственной конфигурации — один из основных вопросов стереохимии.
Методы выделения органических соединений
Для определения строения органических соединений необходима их высокая чистота, отсутствие примесей. Для выделения индивидуальных органических соединений существуют соответствующие методики:
- простая перегонка
- вакуумная перегонка, с водяным паром
- перекристаллизация
- сублимация
- экстракция из раствора, суспензии или твердого состояния;
- хроматография на бумаге
- хроматография в колонках
- газовая хроматография
- жидкостная хроматография
- адсорбционная хроматография
- онкослойная хроматография
- и тому подобное.
Степень чистоты оценивают измерением физических констант индивидуальных веществ: плотности, температуры кипения или плавления, показателя преломления, удельного вращения для энантиомеров и тому подобное.
Важной информацией является элементный состав вещества, который позволяет выяснить тип элементов и их соотношение в молекуле. Молекулярную массу соединений определяют с помощью криоскопии (за снижением температуры замерзания) или ебулиоскопии (по возрастанию температуры кипения), а также современным методом - масс-пектроскопией. На основании элементного анализа и молекулярной массы устанавливают молекулярную брутто-формулу соединения. Для определения определенных структурных фрагментов в молекуле и их пространственного расположения применяют химические и физические методы исследования.
Химические методы
Химические методы анализа позволяют осуществить сложные реакции на определенные связи, элементы, функциональные группы, которые количественно определяют чаще всего с помощью соответствующего титрования. Например, присутствие двойных связей выявляют путем присоединения к ним брома (обесцвечивание бромной воды). Тройную связь устанавливают реакцией с нитратом серебра с образованием осадка соответствующих ацетиленидов.
Функциональные группы определяют с помощью специфических реакций для каждой из них, например, для $HO$-группы пользуются методом ацилирования или фталоилирования по реакции:
 интернет-биржа студенческих работ">
интернет-биржа студенческих работ">
Рисунок 1. Автор24 — интернет-биржа студенческих работ
Уксусную кислоту, образующуюся в процессе реакции, определяют титрованием щелочью с известной концентрацией. Реакции, которые применяются для анализа функциональных групп, будут рассмотрены в соответствующих разделах.
Физические методы
Современная органическая химия невозможна без использования физических (инструментальных) методов анализа состава и строения соединений, которые имеют значительные преимущества перед традиционными химическими:
- малое количество вещества, необходимого для анализа;
- меньше расход времени;
- возможность получения такой информации о строении, которую невозможно получить другими методами (например, мижьядерных расстояний и валентных углы, расположения атомов в пространстве, взаимодействие атомов, определения механизма реакций, наличие водородных связей и т.п.).
К физическим методам анализа органических соединений относятся спектральные, дифракционные и тому подобное. Чаще всего применяют спектральные методы.
Основные физические методы
-
Рефрактометрия определяет молекулярную рефракцию MR, которую рассчитывают на основании определения показателя преломления $n_D^{20}$ по формуле Н. Лорентца - Л. Лоренца:
$M_R=\frac{n^2-1}{n^2+2} \cdot \frac{M}{ρ}$
где $n$ - коэффициент преломления, $M$ - молекулярная масса, $ρ$ - плотность.
Молекулярную рефракцию $MR$ используют для определения строения вещества, она пропорциональна электронной поляризуемости молекулы и качественно оценивает способность соединения к поляризации.
Поляриметрия определяет удельное оптическое вращение $[\alpha]$ плоскости поляризованного света при его прохождении через образец соединения с хиральными (энантиомерными) свойствами.
-
Калориметрия определяет тепловые эффекты реакций с помощью калориметров измерением теплоты сгорания (энтальпию образования), что позволяет устанавливать энергии связей (энтальпию).
-
Дипольные моменты $(μ)$ характеризует полярность, или неравномерность распределения электронной плотности в молекуле:
Рисунок 2. Автор24 — интернет-биржа студенческих работгде $q$ - заряд в центре объекта (связь, молекула), Кл (кулон), $l$ радиус-вектор, соединяющий центры зарядов, м.
При этом $q = δ ε$, где $δ$ - эффективный частичный заряд, $ε$ - элементарный заряд электрона.
В системе СИ дипольный момент измеряется в кулон-метрах (Кл $\cdot$ м), но используют также единицу дебай ($D$).
Для определения $μ$ измеряют диэлектрическую константу соединения на диелкометри.
-
Полярография определяет способность молекулы к восстановлению, что происходит у катода. Это электрохимический метод анализа и основывается на зависимости силы тока и от напряжения $E$ при прохождении тока через раствор.
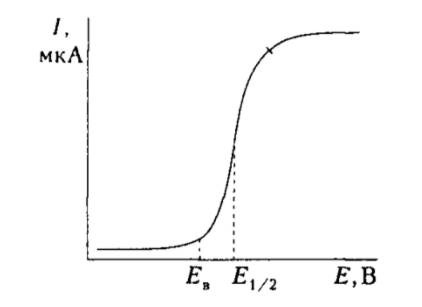
Рисунок 3. Полярограмма восстановления. Автор24 — интернет-биржа студенческих работКривая зависимости $І$ от $E$ характеризует реакции, происходящие на ртутном катоде (присоединение электрона). Восстановление соединения начинается при потенциале восстановления $E$.
Зависимость $І$ от $E$ проявляется в виде полярографической кривой, которая характеризуется потенциалом полуволны $E1/2$ (константа вещества). Значение $E$ показывает на родство молекулы с электроном и может быть использована для сравнения електроноакцепторних свойств.
-
Анодная вольтамперометрия характеризует способность молекулы к окислению на платиновом или графитовом аноде аналогично полярографии. Способность к окислению оценивается значениями потенциала полуволны окисления и которые характеризуют электронодонорные свойства.
- Дифракционные методы анализа основаны на способности соединений рассеивать при облучении электромагнитные колебания благодаря взаимодействию их с электронными оболочками атомов. Вследствие рассеяния появляется дифракционная картина, которую фиксируют чаще на фотопленке в виде точек, круги или пятен разной степени затемнения. Для облучения вещества применяют рентгеновские лучи с длиной волны 0,1-10 нм (рентгенография, или рентгеноструктурный анализ), ускоренные нейтроны (нейтронография) или электроны (электронография).
- Методом рентгенографии определенные структуры таких сложных природных и синтетических соединений, как белки (миоглобин, рибонуклеиновые РНК и дезоксирибонуклеиновые ДНК кислоты), витамин В | 2, полисахариды, пенициллин и др.
С помощью дифракционных методов измеряют межатомные расстояния (длины связей), эффективные радиусы (радиусы Ван-дер-Ваальса), валентные углы между связями, устанавливают расположение атомов в пространстве.