Нитрование - реакция замещения атома водорода органического соединения нитрогруппой:

Иногда нитрогруппу можно ввести в состав органического соединения путем замещения атомов галогена, сульфогруппы, карбоксильной группы и т.д., а также путем присоединения соответствующего реагента по месту двойной связи ненасыщенной соединения. Реакция нитрования - практически необратимая реакция. Для прямого ввода нитрогруппы в остов органических соединений чаще всего применяют следующие соединения или их смеси:
- $HNO_3$ различной концентрации (как правило, на 50\% больше чем стехиометрическая количество). Самая большая концентрация $HNO_3$ ($\rho $ = 1,52) при температуре 15 ${}^\circ$ - 99,67\% кислоты. Азотная кислота бурого цвета, дымит, содержит растворенные оксиды азота (до 12\% и более)
- нитрующая смесь - смесь концентрированных $HNO_3$ и $H_2SO_4$ в соотношении 1: 1;
- нитраты щелочных металлов в присутствии $H_2SO_4$
- нитраты металлов в присутствии уксусного ангидрида и уксусной кислоты
- $HNO_3$ или смесь $HNO_3$ и $H_2SO_4$ с уксусным ангидридом или ледяной уксусной кислотой
- эфиры азотной кислоты - органические нитраты;
- азотистая кислота и $N_2O_4$.
Возможность прохождения реакции нитрования органических соединений, то есть замены водорода на группу -$NO_2$, зависит от строения органического соединения. Насыщенные соединения нитруються трудно, но для них разработана реакция Коновалова - нитрование в паровой фазе. Наиболее легко замещается тот водород, который стоит у третичного атома углерода, но известны также случаи нитрования метиленовых групп. Ненасыщенные соединения легко вступают в реакцию присоединения с нитратной кислотой, образуя нитропроизводные. Реакция нитрования ароматических соединений проходит относительно легко и является одной из важнейших реакций органической химии. Гетероциклические (гетероароматические) соединения также нитруються достаточно легко.
Влияние температуры на парофазное нитрование
Нитрование - реакция экзотермическая, которая проходит с выделением теплоты около 150 кДж / моль на каждую нитрогруппу, поэтому одной из важнейших условий успешного прохождения реакции является соблюдение температурного режима. Несоблюдение оптимальной температуры приводит или к энергичному окислению, или меняет характер замещения, степень нитрования и тому подобное. Также важно медленное добавление азотной кислоты или нитрующей смеси (капельно) к веществу, охлаждение и перемешивание реакционной смеси.
Взаимодействие алканов с азотной кислотой
Насыщенные углеводороды при обычной температуре не взаимодействуют с концентрированной азотной кислотой. При нагревании эта кислота действует как окислитель. Если же на алканы действует разбавленная азотная кислота при нагревании (140 ${}^\circ$С), то может происходить реакция нитрования, в результате которой атомы водорода в молекулах насыщенных углеводородов замещаются на нитрогруппу:
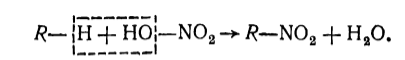
Рисунок 2. Взаимодействие алканов с азотной кислотой. Автор24 — интернет-биржа студенческих работ
Впервые реакцию нитрования алканов совершил в 1888 ${\rm M}$. И. Коновалов, поэтому ее называют реакцией Коновалова.
Скорость реакции нитрования алканов небольшая и выход нитросоединений достаточно низкий. Наилучшие результаты получают при нитровании алканов, имеющих третичные углеродные атомы. Нитрование алканов сопровождается окислительными процессами. На нитрование расходуется только около 40\% азотной кислоты, остальная кислота действует как окислитель. Поэтому при нитровании рядом с нитросоединениями образуются различные добавочные соединения - спирты, альдегиды, кетоны, кислоты. Нитрование алканов сопровождается также разрывом С-С-связей в их молекулах (крекингом), что ведет к образованию нитросоединений с меньшим количеством углеродных атомов, чем у исходного алкана. Так, при нитровании пропана образуется 34\% 1-нитропропана, 32\% 2-нитропропана, 26\% нитроэтана и 8\% нитрометана.
Азотную кислоту, как нитрующей реагент алканов, можно заменить оксидами азота ($\Pi $. П. Шорыгин, А. В. Топчиев, А. И. Титов).
Реакция нитрования алканов радикальный процесс. Начальной стадией этой реакции является взаимодействие углеводорода с оксидом азота (IV), который по строению является радикалом, и образование углеводородных радикалов.
Последние с оксидом азота (IV) дают нитросоединения:
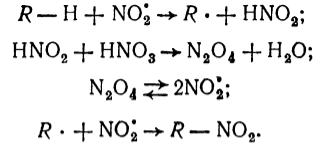
Рисунок 3. Взаимодействие алканов с азотной кислотой. Автор24 — интернет-биржа студенческих работ
Оксид азота (IV) содержится в азотной кислоте и образуется также в результате окисления углеводородов азотной кислотой.
Нитрование парофазным методом
Скорость жидкофазного нитрования небольшая, и выход нитроалканов низкий. В промышленности алканы нитруют парофазным методом (X. Гесс, 1930.) При температуре 300- 500 ${}^\circ$С и в объемном соотношении алкан: азотная кислота 2: 1. Реакция нитрования происходит по механизму SR (как в жидкой, так и в газовой фазе). Нитрующей агентом считается диоксид азота (IV), который являеться по природе радикалом:
Вместо азотной кислоты или ее смеси с серной как нитрующей агент используют также диоксид азота $NO_2$:
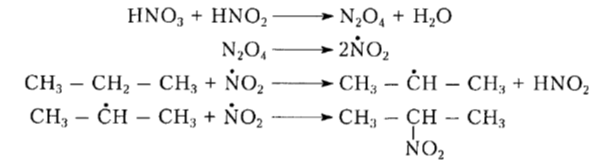
Рисунок 4. Нитрование парофазным методом. Автор24 — интернет-биржа студенческих работ
Так как концентрация стабильного в этих условиях радикала $NO_2$ достаточно большая, то быстро происходит реакция с метильным радикалом, что обеспечивает предельно малую концентрацию радикала -$CH_3$ и исключает развития подобных радикальных алильных цепей. Двуокись азота, таким образом, играет роль интерцептора (перехватчика) метильных радикалов. Механизм парофазного нитрования отличается от механизма галогенирования высокой концентрацией радикальных частиц $NO_2$. В настоящее время в качестве нитрующего агента используют двуокись азота при 450 ${}^\circ$С.
Двуокись азота $NO_2$ представляет собой относительно стабильные неорганические свободные радикалы, димеризующиеся в тетраокись азота $N_2O_4$ только при температурах ниже 150${}^\circ$С. Двуокись азота может играть ту же роль в радикальном замещении водорода в алканах, что и атомы галогенов. Более высокая стабильность радикала $NO_2$ по сравнению с атомарными галогенами определяет меньшую реакционную способность $NO_2$ в радикальных реакциях.
Нитрование алканов в газовой фазе, также как и в жидкой, проходит с расщеплением С-С-связей (деструкцией) с образованием смеси нитропроизводных и кислородсодержащих соединений (спиртов, альдегидов, кетонов, кислот, эфиров азотистой кислоты), причем селективность нитрования не наблюдается:
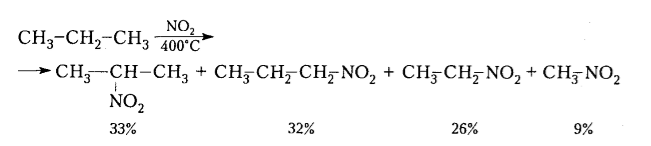
Рисунок 5. Нитрование парофазным методом. Автор24 — интернет-биржа студенческих работ
Таким образом, нитрование алканов проходит по радикальному механизму, с частичной их деструкцией и окислением. Электрофильное нитрование алканов под действием сильных нитрующих электрофилов вроде тетрафторбората нитрония $^+NO_2*BF_{4-}$ происходит с малым выходом и, в отличие от ароматических соединений, для алканов не характерно.











