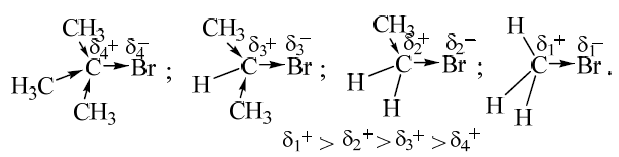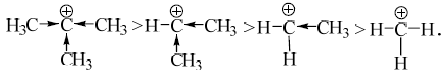Влияние структуры субстрата на реакции нуклеофильного замещения
Существует много реакций, которые не приводят к 100% инверсии или рацемизации. Обращение конфигураций обычно составляет от 5 до 20%, но иногда происходит частичное сохранение конфигурации.
Во многих реакциях $SN1$ продукты реакции образуются из ионных пар, а не из свободного карбокатиона. Поведение $R^+$ в составе ионной пары отличается от поведения свободного карбокатиона. Присутствие противоиона ($Hal^-$) препятствует атаке нуклеофила со стороны уходящей группы, что ведет к обращению конфигурации.
Нуклеофильное замещение может одновременно осуществляться как по $SN1$-механизму, так и по $SN2$-механизму (у вторичных алкилгалогенидов). Соотношение этих механизмов зависит от
- строения субстрата;
- растворителя;
- природы и концентрации нуклеофила;
- природы уходящей группы.
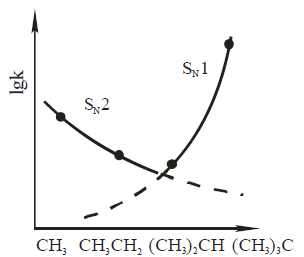
Например: Влияние структуры алкилбромидов на константы скорости реакций их гидролиза водно-спиртовым раствором гидроксида натрия по $SN2$- и $SN1$-механизму отображает рисунок:
Константы скорости $SN2$-реакции уменьшаются в ряду
бромметан > бромэтан > 2-бромпропан > 2-бром-2-метилпропан.
Влияние электронных и стерических факторов на скорость реакции
На это оказывают влияние:
- Электронные факторы. Их влияние невелико. Увеличение числа метильных заместителей ведет к уменьшению частичного положительного заряда на атоме углерода, связанного с бромом, в результате чего затрудняется его атака нуклеофилом.
- Стерические факторы. При увеличении числа алкильных заместителей у атома углерода, связанного с бромом, гидроксид-аниону все труднее атаковать этот атом. При механизме $SN2$ в переходном состоянии вокруг атома углерода должны находиться пять групп атомов, в то время как в исходном галогениде – четыре. Чем больше стерическая напряженность переходного состояния по сравнению с исходными соединениями, тем медленнее оно образуется и тем выше его энергия.
Например: С электронными и стерическими факторами связано снижение скорости реакций, проходящих по $SN2$-механизму, в ряду
2-бром-2-метилпропан > 2-бромпропан > бромэтан > бромметан
В этом ряду стабилизация карбокатиона уменьшается, что обусловлено действием индуктивного эффекта
А также действием эффекта сверхсопряжения, в котором принимают участие атомы водорода, связанные с $\alpha$-углеродным атомом
В соответствии с этим рядом, карбокатионы имеют по 9, 6, 3, 0 атомов водорода.
При переходе от исходного алкилгалогенида с четырьмя заместителями, тетраэдрически расположенными вокруг атома углерода в $sp3$-гибридизации к карбокатиону с тремя заместителями с плоским расположением вокруг $sp2$-гибридизированного атома углерода.
В плоском карбокатионе заместители максимально удалены друг от друга. Поэтому снижение напряженности при переходе от галогенида к карбокатиону, по мере увеличения размеров заместителей, увеличивается.
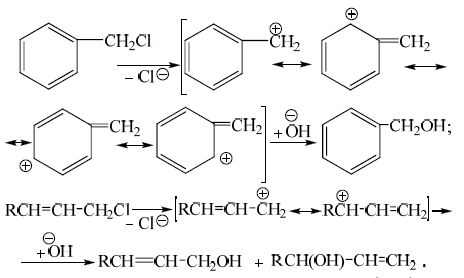
Если можно осуществить стабилизацию карбокатиона в результате эффекта сопряжения, то замещение по $SN1$-механизму может легко проходить у первичного атома углерода, например, в хлористом бензиле:
Замещение может быть осложнено аллильной перестановкой карбокатиона, что приводит к образованию двух изомерных спиртов:

Побочные реакции, конкуренция механизмов SN1, SN2 и Е1, Е2
Реакции, протекающие по механизмам $SN1$ и $SN2$ могут сопровождаться побочными превращениями, например, реакциями отщепления (элиминирования). Эти реакции осуществляются параллельно с реакциями нуклеофильного замещения.
Реакции нуклеофильного замещения $SN1$ и реакции отщепления $E1$ имеют общий карбокатионный интермедиат, который в ходе быстрой нелимитирующей стадии может превращаться или в продукты замещения или в продукты отщепления.
Увеличить долю реакций замещения относительно реакций отщепления можно разными способами:
- Так как для любого субстрата соотношение $SN1$ / $E1$ всегда выше, чем соотношение $SN2$ / $E2$, то для того, чтобы увеличить значимость процесса замещения, нужно увеличить скорость реакций, проходящих по $SN1$- , $E1$-механизмам или, наоборот, снизить скорость реакций $SN2$ и $E2$. Для этого используют более полярный растворитель, менее концентрированный и активный нуклеофил. Например: Для гидролиза галогеналкилов применяют разбавленные водные растворы карбонатов, а для элиминирования – концентрированную спиртовую щелочь.
- В ряду углеводородных радикалов первичный – вторичный – третичный будет увеличиваться образование продуктов элиминирования, устойчивость переходного состояния $E1$- и $E2$-механизмов, стабильность разветвленных этиленовых углеводородов в результате воздействия эффекта сверхсопряжения.
- Соотношение продуктов реакций $SN2$ / $E2$ зависит от природы уходящей группы, так как расщепляющая связь $C-X$ содержится в каждом альтернативном переходном состоянии.
- Доля замещения всегда снижается по отношению к отщеплению при повышении температуры.